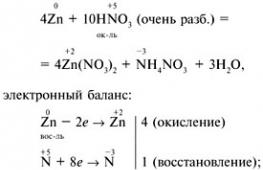Otrzymywanie i właściwości tlenu. Substancje gazowe w chemii nieorganicznej i organicznej Gaz może być zbierany metodą wypierania powietrza
Test „Azot i jego związki”
opcja 1 1. Najsilniejsza cząsteczka a) H2; b) F2; c) O2; d) N2. 2. Barwa fenoloftaleiny w roztworze amoniaku: a) szkarłatny; b) zielony; c) żółty; d) niebieski. 3. Stopień utlenienia wynosi +3 przy atomie azotu w związku: a) NH 4 NO 3; b) NaNO3; c) NO2; d) KNO 2. 4. Podczas rozkładu termicznego azotanu miedzi(II) powstają:a) azotyn miedzi (II) i O 2 ;b) tlenek azotu(IV) i O 2 ;c) tlenek miedzi(II), gaz brązowy NO 2 i O2; d) wodorotlenek miedzi (II), N 2 i O 2. 5. Który jon powstaje w mechanizmie dawcy-akceptora? a) NH4+; b) NO 3 - ; c) Cl-; d) SO 4 2–. 6. Określ mocne elektrolity: a) kwas azotowy; b) kwas azotawy; c) wodny roztwór amoniaku; d) azotan amonu. 7. Podczas interakcji uwalniany jest wodór: a) Zn + HNO 3 (razb.); b) Cu + HCl (roztwór); c) Al + NaOH + H2O; d) Zn + H2SO4 (razb.); e) Fe + HNO3 (stęż.). 8. Napisz równanie reakcji cynku z bardzo rozcieńczonym kwasem azotowym, jeśli jednym z produktów reakcji jest azotan amonu. Określ współczynnik przed środkiem utleniającym. 9.Nazwij substancje A, B, C. Opcja 2 1. Nie można zbierać metodą wypierania wody: a) azotu; b) wodór; c) tlen; d) amoniak. 2. Odczynnikiem dla jonu amonowego jest roztwór: a) siarczanu potasu; b) azotan srebra; c) wodorotlenek sodu; d) chlorek baru. 3. Podczas interakcji z HNO 3 (stęż.) powstaje gaz z wiórów miedzianych: a) N2O; b) NH3; c) NO2; d) H2. 4. Rozkład termiczny azotanu sodu powoduje: a) tlenek sodu, brązowy gaz NO 2, O 2; b) azotyn sodu i O 2 c) sód, brązowy gaz NO 2, O 2 d) wodorotlenek sodu N 2, O 2. 5. Stopień utlenienia azotu w siarczanie amonu: a)-3; b)-1; c) +1; d) +3. 6. Z którą z poniższych substancji reaguje stężony HNO? 3 w normalnych warunkach? a) NaOH; b) AgCl; c) Al; d) Fe; e) Cu. 7. Podaj liczbę jonów w skróconym równaniu jonowym dla oddziaływania siarczanu sodu i azotanu srebra: a) 1; b) 2; w 3; d) 4. 8. Napisz równanie oddziaływania magnezu z rozcieńczonym kwasem azotowym, jeśli jeden z produktów reakcji jest substancją prostą. Określ współczynnik w równaniu przed środkiem utleniającym. 9. Napisz równania reakcji dla następujących przekształceń:
Nazwij substancje A, B, C, D.
Odpowiedzi
opcja 1 1 - G; 2 - ale; 3 - G; 4 - w; 5 - ale; 6 -a, d; 7 - Płyta CD; 8 – 10,


2Ag + + SO 4 2– = Ag 2 SO 4;
8 – 12, 9. A - NO, B - NO 2, C - HNO 3, D - NH 4 NO 3,
Zbieranie gazów
Metody zbierania gazów determinują ich właściwości: rozpuszczalność i oddziaływanie z wodą, powietrzem, zatrucie gazu. Istnieją dwie główne metody gromadzenia gazu: wypieranie powietrza i wypieranie wody. Przemieszczenie powietrza zbierać gazy, które nie oddziałują z powietrzem.
Na podstawie względnej gęstości gazu w powietrzu wyciąga się wniosek, jak ustawić naczynie do zbierania gazu (rys. 3, a i b).
Na ryc. 3a pokazuje gromadzenie gazu o gęstości powietrza większej niż jedność, takiego jak tlenek azotu (IV), którego gęstość powietrza wynosi 1,58. Na ryc. 3b przedstawia gromadzenie gazów o gęstości powietrza mniejszej niż jedność, takich jak wodór, amoniak itp.
Wypierając wodę, gromadzone są gazy, które nie wchodzą w interakcje z wodą i są w niej słabo rozpuszczalne. Ta metoda nazywa się zbieranie gazu nad wodą , który przeprowadza się w następujący sposób (ryc. 3, c). Cylinder lub słoik jest wypełniony wodą i przykryty szklaną płytką, aby w cylindrze nie pozostały pęcherzyki powietrza. Płyta jest trzymana ręcznie, cylinder jest odwracany i opuszczany do szklanej kąpieli wodnej. Pod wodą płyta jest usuwana, rurka wylotowa gazu jest wprowadzana do otwartego otworu butli. Gaz stopniowo wypiera wodę z butli i napełnia ją, po czym otwór butli pod wodą zamyka się szklaną płytką i butlę napełnioną gazem usuwa się. Jeśli gaz jest cięższy od powietrza, butlę kładzie się na stole do góry nogami, a jeśli jest lżejszy, to do góry nogami na talerzu. Gazy nad wodą można zbierać w probówkach, które podobnie jak cylinder napełnia się wodą, zamyka palcem i wlewa do szklanej lub szklanej kąpieli z wodą.
Toksyczne gazy są zwykle gromadzone przez wypieranie wody, ponieważ łatwo zauważyć moment, w którym gaz całkowicie wypełnia naczynie. Jeśli istnieje potrzeba zbierania gazu metodą wypierania powietrza, należy w tym celu postępować w następujący sposób (ryc. 3, d).
Do kolby (słoiczka lub butli) wkłada się korek z dwoma rurkami wylotowymi gazu. Przez jeden, sięgający prawie do samego dna, wpuszczany jest gaz, przez drugi wpuszczany jest do szklanki (słoika) z roztworem pochłaniającym gaz. Na przykład, aby zaabsorbować tlenek siarki (IV), do szklanki wlewa się roztwór alkaliczny, a do szklanki wlewa się wodę, aby zaabsorbować chlorowodór. Po napełnieniu kolby (słoika) gazem, korek z rurkami wylotowymi gazu wyjmuje się z niego i naczynie szybko zamyka się korkiem lub płytką szklaną, a korek z rurkami wylotowymi gazu umieszcza się w roztworze absorbującym gaz.
Doświadczenie 1. Pozyskiwanie i gromadzenie tlenu
Zmontuj instalację zgodnie z ryc. 4. W dużej suchej probówce umieścić 3-4 g nadmanganianu potasu, zamknąć korkiem z rurką wylotową gazu. Zamocuj probówkę w statywie ukośnie z otworem lekko do góry. Obok statywu, na którym zamocowana jest probówka, ustaw krystalizator z wodą. Pustą probówkę napełnić wodą, otwór zatkać szklaną płytką i szybko odwrócić do góry nogami do krystalizatora. Następnie w wodzie wyjmij szklaną płytkę. W probówce nie powinno być powietrza. Podgrzej nadmanganian potasu w płomieniu palnika. Zanurz koniec rurki wylotowej gazu w wodzie. Obserwuj pojawianie się pęcherzyków gazu.
Kilka sekund po rozpoczęciu bąbelków włożyć koniec rurki wylotowej gazu do otworu probówki wypełnionej wodą. Tlen wypiera wodę z rurki. Po napełnieniu probówki tlenem zakryj jej otwór szklaną płytką i odwróć ją do góry nogami.
1. Jakie znasz laboratoryjne metody pozyskiwania tlenu? Napisz odpowiednie równania reakcji.
2. Opisz swoje obserwacje. Wyjaśnij położenie probówki podczas eksperymentu.
3. Napisz równanie reakcji chemicznej rozkładu nadmanganianu potasu po podgrzaniu.
4. Dlaczego tlący się odłamek wybucha w probówce z tlenem?
Doświadczenie 2. Produkcja wodoru działanie metalu na kwas
Zmontuj aparat składający się z probówki z korkiem, przez który przechodzi szklana probówka z wycofanym końcem (rys. 5). W probówce umieścić kilka kawałków cynku i dodać rozcieńczony roztwór kwasu siarkowego. Mocno włóż korek z odciągniętą probówką, zamocuj probówkę pionowo w uchwycie statywu. Obserwuj wydzielanie się gazu.
Jeśli powietrze jest obecne w probówce z wodorem, następuje niewielka eksplozja, której towarzyszy ostry dźwięk. W takim przypadku należy powtórzyć badanie czystości gazu. Po upewnieniu się, że z urządzenia wydostaje się czysty wodór, podpal go w otworze wyciąganej rurki.
Pytania i zadania kontrolne:
1. Określić metody otrzymywania i gromadzenia wodoru w laboratorium. Napisz odpowiednie równania reakcji.
2. Napisz równanie reakcji chemicznej wytwarzania wodoru w warunkach eksperymentalnych.
3. Trzymaj suchą rurkę nad płomieniem wodoru. Jaka substancja powstaje w wyniku spalania wodoru? Napisz równanie reakcji spalania wodoru.
4. Jak sprawdzić czystość wodoru otrzymanego podczas eksperymentu?
Doświadczenie 3. Uzyskiwanie amoniaku
Pytania i zadania kontrolne:
1. Jakie znasz związki wodorowe azotu? Napisz ich formuły i nazwy.
2. Opisz, co się dzieje. Wyjaśnij położenie probówki podczas eksperymentu.
3. Napisz równanie reakcji chlorku amonu z wodorotlenkiem wapnia.
Doświadczenie 4. Otrzymywanie tlenku azotu (IV)
Zmontuj urządzenie zgodnie z ryc. 7. Do kolby wsypać wióry miedziane, do lejka wlać 5-10 ml stężonego kwasu azotowego. Wlej kwas do kolby małymi porcjami. Zbierz ulatniający się gaz w probówce.
Pytania i zadania kontrolne:
1. Opisz, co się dzieje. Jaki jest kolor ulatniającego się gazu?
2. Napisz równanie reakcji oddziaływania miedzi ze stężonym kwasem azotowym.
3. Jakie właściwości ma kwas azotowy? Jakie czynniki decydują o składzie substancji, do których jest redukowany? Podaj przykłady reakcji metali z kwasem azotowym, w wyniku których produktami redukcji HNO 3 są NO 2 , NO, N 2 O, NH 3 .
Doświadczenie 5. Uzyskiwanie chlorowodoru
Umieścić 15-20 g chlorku sodu w kolbie Wurtza; do wkraplacza - stężony roztwór kwasu siarkowego (ryc. 8). Włóż koniec rurki wylotowej gazu do suchego naczynia do zbierania chlorowodoru tak, aby rurka sięgała prawie do dna. Zamknij otwór naczynia luźną kulką waty.
Umieść krystalizator z wodą obok urządzenia. Wlej roztwór kwasu siarkowego z wkraplacza.
Lekko ogrzej kolbę, aby przyspieszyć reakcję. Kiedy się skończy
wata, którą zamyka się otwór naczynia, pojawi się mgła,
Pytania i zadania kontrolne:
1. Wyjaśnij zaobserwowane zjawiska. Jaki jest powód powstawania mgły?
2. Jaka jest rozpuszczalność chlorowodoru w wodzie?
3. Przetestuj powstały roztwór papierkiem lakmusowym. Jaka jest wartość pH?
4. Napisz równanie reakcji chemicznej oddziaływania stałego chlorku sodu ze stężonym Kwas Siarkowy.
Doświadczenie 6. Pozyskiwanie i zbieranie tlenku węgla (IV)
Instalacja składa się z aparatu Kipp 1 , naładowany kawałkami marmuru i kwasem solnym, dwie kolby Tiszczenki połączone szeregowo 2 I 3 (butelka 2 napełniona wodą w celu oczyszczenia przechodzącego tlenku węgla (IV) z chlorowodoru i zanieczyszczeń mechanicznych, butelka 3 - kwas siarkowy do suszenia gazu) i kolby 4 o pojemności 250 ml do zbierania tlenku węgla (IV) (rys. 9).
Ryż. 9. Urządzenie do otrzymywania tlenku węgla (IV)
Pytania i zadania kontrolne:
1. Opuść zapaloną pochodnię do kolby z tlenkiem węgla (IV) i wyjaśnij, dlaczego płomień gaśnie.
2. Napisz równanie powstawania tlenku węgla (IV).
3. Czy do uzyskania tlenku węgla (IV) można użyć stężonego roztworu kwasu siarkowego?
4. Gaz uwolniony z aparatu Kippa przepuścić do probówki z wodą zabarwioną neutralnym roztworem lakmusu. Co jest obserwowane? Napisz równania reakcji zachodzącej, gdy gaz rozpuszcza się w wodzie.
Pytania testowe:
1. Wymień główne cechy gazowego stanu materii.
2. Zaproponować klasyfikację gazów według 4-5 zasadniczych cech.
3. Jak czyta się prawo Avogadro? Jakie jest jego matematyczne wyrażenie?
4. Wyjaśnij fizyczne znaczenie średniej masy molowej mieszaniny.
5. Oblicz średnią masę molową powietrza warunkowego, w którym udział masowy tlenu wynosi 23%, a azotu 77%.
6. Który z następujących gazów jest lżejszy od powietrza: tlenek węgla (II), tlenek węgla (IV), fluor, neon, acetylen C 2 H 2, fosfina PH 3?
7. Wyznacz gęstość wodoru mieszaniny gazowej składającej się z argonu o objętości 56 litrów i azotu o objętości 28 litrów. Objętości gazów podano i.n.o.
8. Otwarte naczynie jest podgrzewane pod stałym ciśnieniem od 17 ° C do 307 ° C. Jaka część powietrza (wagowo) w naczyniu jest przemieszczana?
9. Wyznacz masę 3 litrów azotu w temperaturze 15°C i ciśnieniu 90 kPa.
10. Masa 982,2 ml gazu w temperaturze 100°C i ciśnieniu 986 Pa wynosi 10 g. Określ masę molową gazu.
PRACA PRAKTYCZNA (1 godz.) Klasa 8
Praca wykonywana jest przez uczniów samodzielnie pod kierunkiem prowadzącego.
Oferuję efekt mojej wieloletniej pracy nad przygotowaniem i prowadzeniem pracy praktycznej w szkole ogólnokształcącej na lekcjach chemii w klasach 8-9:
- Pozyskiwanie i właściwości tlenu,
- „Przygotowywanie roztworów soli o określonym ułamku masowym rozpuszczonej substancji”,
- „Uogólnienie informacji o najważniejszych klasach związków nieorganicznych”,
- „Dysocjacja elektrolityczna”,
- „Podgrupa tlenowa” (patrz kolejny numer gazety „Chemia”).
Wszystkie są przeze mnie testowane w klasie. Mogą być stosowane w nauce szkolnego kursu chemii zarówno według nowego programu OS Gabrielyana, jak i według programu G.E. Rudzitisa, F.G. Feldmana.
Eksperyment studencki to rodzaj samodzielnej pracy. Eksperyment nie tylko wzbogaca uczniów o nowe koncepcje, umiejętności, umiejętności, ale także jest sposobem na zweryfikowanie prawdziwości zdobytej wiedzy, przyczynia się do głębszego zrozumienia materiału, przyswojenia wiedzy. Pozwala pełniej realizować zasadę zmienności w postrzeganiu otaczającego świata, ponieważ główną istotą tej zasady jest związek z życiem, z przyszłą działalnością praktyczną uczniów.
Cele. Umieć odbierać tlen w laboratorium i pobierać go dwoma metodami: wypieraniem powietrza i wypieraniem wody; potwierdzić doświadczalnie właściwości tlenu; znać zasady bezpieczeństwa.
Sprzęt. Stojak metalowy ze stopką, lampka spirytusowa, zapałki, probówka z rurką wylotową gazu, probówka, wacik, pipeta, zlewka, drzazga, igła (lub drut) preparacyjna, krystalizator z wodą, dwie kolby stożkowe z korkami.
Odczynniki. KMnO 4 krystaliczny (5–6 g), Ca (OH) 2 woda wapienna, węgiel drzewny,
Fe (drut stalowy lub spinacz do papieru).
Zasady bezpieczeństwa.
Ostrożnie obchodzić się ze sprzętem chemicznym!
Pamiętać! Probówkę ogrzewa się, trzymając ją w pozycji pochylonej, na całej jej długości dwoma lub trzema ruchami w płomieniu lampy alkoholowej. Podczas ogrzewania kieruj otwór probówki z dala od siebie i sąsiadów.
Wcześniej uczniowie otrzymują prace domowe związane z przestudiowaniem treści nadchodzącej pracy zgodnie z instrukcją, jednocześnie korzystając z materiałów podręczników ósmej klasy O.S. Gabrielyana (§ 14, 40) lub G.E. Rudzitisa, F.G. Feldmana (§ 19, 20). W zeszytach do pracy praktycznej spisują nazwę tematu, cel, wymieniają sprzęt i odczynniki, sporządzają tabelę do raportu.
PODCZAS ZAJĘĆ
Jedno doświadczenie stawiam wyżej
niż tysiąc opinii
tylko urodzony
wyobraźnia.
M.V. Lomonosov
Pozyskiwanie tlenu
metoda wypierania powietrza
(10 minut)
1. Nadmanganian potasu (KMnO 4) umieścić w suchej probówce. Umieść luźną kulkę waty w otworze probówki.
2. Zamknąć probówkę korkiem z rurką wylotową gazu, sprawdzić szczelność (rys. 1).
|
Ryż. jeden.
|
(Objaśnienia nauczyciela dotyczące sprawdzania szczelności urządzenia.) Zamocuj urządzenie w nodze statywu.
3. Opuść rurkę wylotową gazu do szyby, nie dotykając dna, na odległość 2-3 mm (rys. 2).
4. Rozgrzej substancję w probówce. (Pamiętaj o przepisach bezpieczeństwa.)
5. Sprawdź obecność gazu za pomocą tlącego się drzazgi (węgiel drzewny). Co oglądasz? Dlaczego tlen można zbierać przez wypieranie powietrza?
6. Zbierz powstały tlen do dwóch kolb do kolejnych eksperymentów. Zamknąć kolby korkami.
7. Przygotuj raport korzystając z tabeli. 1, którą umieszczasz na rozkładówce swojego notatnika.
Pozyskiwanie tlenu
metoda wypierania wody
(10 minut)
1. Napełnij probówkę wodą. Zamknij tubkę kciukiem i odwróć ją do góry nogami. W tej pozycji opuść rękę z probówką do krystalizatora z wodą. Doprowadzić probówkę do końca rurki wylotowej gazu bez wyjmowania jej z wody (rys. 3).
2. Gdy tlen wypchnie wodę z rurki, zamknij ją kciukiem i wyjmij z wody. Dlaczego tlen można zbierać poprzez wypieranie wody?
Uwaga! Wyjąć rurkę wylotową gazu z krystalizatora, kontynuując ogrzewanie rurki za pomocą KMnO 4 . Jeśli tego nie zrobisz, woda zostanie wrzucona do gorącej probówki. Czemu?
Spalanie węgla w tlenie
(5 minut)
1. Zamocuj węgiel na metalowym drucie (igła preparacyjna) i włóż go w płomień lampy alkoholowej.
2. Opuść rozgrzany węgiel do kolby z tlenem. Co oglądasz? Podaj wyjaśnienie (rysunek 4).
3. Po wyjęciu niespalonego węgla z kolby wlej do niej 5-6 kropli wody wapiennej
Ca(OH)2. Co oglądasz? Podaj wyjaśnienie.
4. Wydaj raport z pracy w tabeli. jeden.
Płonący drut stalowy (żelazny)
w tlenie
(5 minut)
1. Przymocuj kawałek zapałki do jednego końca stalowego drutu. Zapal zapałkę. Zanurz drut z płonącą zapałką w kolbie z tlenem. Co oglądasz? Podaj wyjaśnienie (rysunek 5).
2. Wydaj raport z pracy w tabeli. jeden.
Tabela 1
| Operacje w toku (co oni robili) |
Liczby z oznaczeniami substancji wyjściowych i otrzymanych | Obserwacje. Warunki przeprowadzanie reakcji. równania reakcji |
Wyjaśnienia obserwacji. wnioski |
|---|---|---|---|
| Montaż urządzenia do pozyskiwania tlenu. Sprawdzenie urządzenia pod kątem wycieków | |||
| Pozyskiwanie tlenu od KMnO 4 po podgrzaniu |
|||
| Dowód produkcji tlenu z tlący się drzazga |
|||
| Charakterystyka właściwości fizycznych O 2. Zbieranie O 2 dwoma metodami: wyporność powietrza, wyporność |
|||
| Charakterystyka właściwości chemiczne O 2. Interakcja z prostymi substancjami spalanie węgla, palenie żelaza (drut stalowy, spinacz do papieru) |
Sporządź pisemny ogólny wniosek dotyczący wykonanej pracy (5 min).
WYJŚCIE. Jednym ze sposobów pozyskiwania tlenu w laboratorium jest rozkład KMnO 4 . Tlen jest bezbarwnym i bezwonnym gazem, 1,103 razy cięższym od powietrza ( Pan(O 2) \u003d 32, Pan(powietrze) \u003d 29, z czego wynika 32/29 1,103), słabo rozpuszczalny w wodzie. Reaguje z prostymi substancjami tworząc tlenki.
Uporządkuj miejsce pracy (3 min): zdemontuj urządzenie, ułóż naczynia i akcesoria na swoich miejscach.
Prześlij swoje notatniki do recenzji.
Praca domowa.
Zadanie. Określ, który ze związków żelaza - Fe 2 O 3 lub Fe 3 O 4 - jest bogatszy w żelazo?
| Dany: | Znaleźć: |
| Fe 2 O 3, Fe 3 O 4 . |
(Fe) w Fe 2 O 3, „(Fe) do Fe 3 O 4 |
Rozwiązanie
(X) = n A r(X)/ Pan, gdzie n- liczba atomów pierwiastka X we wzorze substancji.
Pan(Fe 2 O 3) \u003d 56 2 + 16 3 \u003d 160,
(Fe) \u003d 56 2/160 \u003d 0,7,
(Fe) = 70%,
Pan(Fe 3 O 4) \u003d 56 3 + 16 4 \u003d 232,
„(Fe) \u003d 56 3/232 \u003d 0,724,
„(Fe) = 72,4%.
Odpowiedź. Fe 3 O 4 jest bogatszy w żelazo niż Fe 2 O 3 .
W trakcie pracy praktycznej nauczyciel monitoruje poprawność wykonania technik i operacji przez uczniów oraz zapisuje w karcie ewidencji umiejętności (tab. 2).
Tabela 2
Karta rekordu umiejętności
| Operacje praktycznej pracy | Nazwiska uczniów | |||||
|---|---|---|---|---|---|---|
| ALE | b | W | g | D | mi | |
| Montaż urządzenia do pozyskiwania tlenu | ||||||
| Sprawdzenie urządzenia pod kątem wycieków | ||||||
| Mocowanie probówki w nodze statywu | ||||||
| Obsługa lampy alkoholowej | ||||||
| Ogrzewanie probówki z KMnO 4 | ||||||
| Sprawdzanie uwalniania O 2 | ||||||
| Zbieranie O 2 w naczyniu dwoma metodami: wyporność powietrza, wyporność |
||||||
| spalanie węgla | ||||||
| Spalanie Fe (drut stalowy) | ||||||
| Kultura eksperymentalna | ||||||
| Wykonywanie pracy w zeszycie | ||||||
Przykładowy raport z wykonanej pracy praktycznej (tabela 1)
tlący się drzazga
(węgiel) świeci jasno
w O 2
właściwości fizyczne O 2. Zbieranie O 2 dwoma metodami:
wyporność powietrza (a),
wyporność (b)

nieco cięższy od powietrza, więc
zbiera się go w naczyniu umieszczonym na dnie. Tlen jest słabo rozpuszczalny w wodzie


Woda wapienna staje się mętna, ponieważ tworzy się nierozpuszczalny w wodzie osad CaCO 3 :
CO 2 + Ca (OH) 2 CaCO 3 + H 2 O. Żelazo pali się jasnym płomieniem w tlenie:

z prostym
substancje - metale i niemetale. Powstanie białego osadu potwierdza obecność CO 2 w kolbie
CHEMIA
Wniosek
Zadanie 1.
Podano substancje gazowe: H2, HCl, CO2, CO, O2, NH3.
1. Określ, które z nich są lżejsze od powietrza, a które cięższe (uzasadnij odpowiedź).
2. Określ, które z nich nie mogą zostać zebrane przez przemieszczenie wody.
3. Określ, co stanie się z tymi gazami, jeśli zostaną przepuszczone przez roztwór kwasu, zasady (potwierdź odpowiedź równaniami reakcji).
Rozwiązanie.
1. Lżejsze od powietrza, te, których masa molowa jest mniejsza niż 29 g / mol (masa molowa powietrza). Ten H2, CO, NH3. Cięższe: HCl, CO2, O2.
2. Metoda wypierania wody może gromadzić gazy, które są nierozpuszczalne lub słabo rozpuszczalne w wodzie. Ten H 2 , CO 2 , CO , O 2 . Nie można zbierać gazów przez wypieranie wody: HCl, NH3.
3. Substancje o właściwościach zasadowych reagują z kwasami:
NH3 + HCl = NH4Cl
Substancje o właściwościach kwasowych reagują z zasadami:
HCl + KOH = KCl + H2O
Tak 1.
Gaz tarizdі zattar berіlgen: H2, HCl, CO2, CO, O2, NH3.
1.Olardyn kaysysy auadan auyr zhane kaysysy zhenіl ekenіn anyқtaңyzdar (zhauaptaryңyzdy deleldenіzder).
2. Sądy Olardyn kaysysyn ygystyru adіsimen anyktauga bolmaytynyn anyktanyzdar.
3. Yeger olardy sіltinіn, қyshқyldyң erіtіndіlerі arkyly өtkіzgende osy gazdarmen ne bolatynyn anyktaңyzdar (zhauaptaryңyzdy reakcja teңdeuleri ақылідідінізтер).
Szeszui.
1. Auadan zhenil, yagni molyarlyk massasy 29 g/moldan (auanyn molyarlyk massasy) kishi bolatyn gasdar: H2, CO, NH3. Auyr: HCl, CO2, O2.
2. Sądy yғgystyru adіsimen sądu erіmeitіn nemes sądu az eritіn gazdardy aluga bolady. Olar To jest H2, CO2, CO, O2. Sądy ygystyru adіsi arkyly zhinauga bolmaityn gazdar: HCl, NH3.
3. Қyshқylmen negіzdіk қasiet korsetetіn zattar аrekettesedі:
NH3 + HCl = NH4Cl
Sіltіlermen қyshқyldyқ қasiet kөrsetetіn zattar аrekettesedі:
HCl + KOH = KCl + H2O
CO2 + 2KOH = K2CO3 + H2O lub CO2 + KOH = KHCO3
Zadanie 2.
Wczesną wiosną, wcześnie rano, gdy temperatura otoczenia wynosiła jeszcze 0°C, a ciśnienie 760 mm Hg. Art., trzej towarzysze spacerujący z psami zobaczyli na trawniku pustą butelkę. – Jest pusty – powiedział jeden z nich. „Nie, jest pełny po brzegi i znam formułę tego, czym jest wypełniony” – powiedział inny. – Obaj się mylicie – powiedział trzeci.
1. Który z towarzyszy, Twoim zdaniem, miał rację (uzasadnij odpowiedź)?
2. Oblicz ilość substancji i liczbę cząstek zawartych w butelce, jeśli jej objętość wynosi 0,7 dm3.
3. Oblicz masę molową gazu zawartego w butelce.
Rozwiązanie.
1. Trzecia ma rację, bo w butelce jest powietrze (nie jest pusta - pierwsza jest zła), a powietrze nie jest indywidualną substancją (druga też jest zła). Powietrze jest mieszaniną gazów:
2. Skoro warunki są normalne, toV m = 22,4 l/mol. Oblicz ilość substancjin = V / V m \u003d 0,7 / 22,4 l / mol \u003d 0,03125 mol. Liczba cząstekn = n A n\u003d 6,02 1023 mol-1 0,03125 mol \u003d 1,88 1022 cząstek.
3. Masę molową powietrza można obliczyć znając skład powietrza. Powietrze zawiera około 78% N 2 , 21% O 2 , 0,5% Ar i 0,5% CO 2 . Średnia masa molowa będzie równam cf = x jeden · m 1 + x 2 · m 2 + x 3 · m 3 + x 4 · m 4
Tak 2.
Erte koktemde tanerten erte korshagan ortanyn temperatura sy 0 °C, kysym 760 mm syn. błąd. bolyp turgan kezde ush adam ozderinin ytterin kydyrtuғa shykty zhane olar gazondagy bos құtyny (butelka) kөrdі. "Ol szef" - dziadek Onyn Bireui. „Joq, auzina deyin zattarmen toly” dziadek ekіnshіsi, sebi ol құtynyң ishіndegі zattardyn formulyasyn bіladі. „Sender ekeulerin de durys tappadyndar” - dziadek ushіnshіsi.
1. Sіzderdin oylaryңyzsha, osy үsh adamnyn kaysysy dұrys oilady (zhauaptaryңdy deleldenger)?
2. Yeger құtynyn (butylkanyң) ishіndegі zattyң kolemi 0,7 dm3 - on ten bolatyn belgili bolsa, zat molsherin zhane molekularny sanyn tabynyzdar.
3. Kutynyn ishindegi gazdyn molyarlyk massasyn eseptenіzder.
Szeszui.
1. Ushіnshi adam durys aitty, sebebі onynіshіnde aua bar (ol bos emes, endeshe birinshi adam durys tappady), al aua zheke zat emes (sol sebeptі ekіnshi adam da durys tappady). Aua birneshe gazdardyn kospasynan turady: N 2, O 2, Ar, CO 2, H 2 O itd.
2. Yagni zhagday kalypty, endeszeV m = 22,4 l/mol. Zat molsherin esepteymizn = V / V m \u003d 0,7 / 22,4 l / mol \u003d 0,03125 mol. sana molekułan = n A n = 6,02 1023 mol-1 0,03125 mol = 1,88 1022 bolik.
3. Auanyn kuramyn bile otyryp auanyn molyarlyk massasyn esepteuge bolady. Aua shamamen tomendegi gazdar cospasynan turady: 78% N 2, 21% O 2, 0,5% Ar i 0,5% CO 2 . Ortasha molyarlyk massas dziesięć boladasm cf = x jeden · m 1 + x 2 · m 2 + x 3 · m 3 + x 4 · m 4 = 0,78 28 + 0,21 32 + 0,05 40 + 0,05 44 ≈ 29 g/mol.
Zadanie 3.
Masz do dyspozycji węglan wapnia i kwas solny. Zaproponuj metody syntezy co najmniej 6 nowych substancji, w tym 2 prostych. W syntezach można stosować tylko materiały wyjściowe, produkty ich wzajemnego oddziaływania, niezbędne katalizatory i prąd elektryczny.
Rozwiązanie.
1. CaCO 3 \u003d CaO + CO 2 (po podgrzaniu)
2.
3.
4. CaO + H2O = Ca(OH)2
5. CaCl 2 \u003d Ca + Cl 2 (elektroliza stopiona)
6. 2 HCl \u003d H 2 + Cl 2 (elektroliza roztworu)
7. 2H2O = 2H2 + O2 (elektroliza)
8. Ca + H2 = CaH2
9. Ca(OH)2 + Cl2 = CaOCl2 + H2O (w 0ºC)
10. po podgrzaniu)
11. Cl2 + H2O = HCl + HClO (w 0ºC)
12. 3 Cl 2 + 3 H 2 O \u003d 5 HCl + HClO 3 (po podgrzaniu)
Esep3.
Wapń sizderde węglan y zhane tuz kyshkyly bar. Osy zattar arkyly 6-dan przez kogo emes zhana zattardy, onyn ishinde 2 zhai zattardy kalay aluga bolady? Synteza tek kana bastapky zattardy, olardan alyngan onnіmderdi koldanuga bolady, katalizator zhane electr togy kazhet.
Szeszui.
1. CaCO 3 \u003d CaO + CO 2 (kyzdyrganda)
2. CaCO3 + HCl = CaCl2 + CO2 + H2O
3. CaCO3 + CO2 + H2O = Ca(HCO3)2
4. CaO + H2O = Ca(OH)2
5. CaCl 2 \u003d Ca + Cl 2 (elektroliza balkymy i)
6. 2 HCl \u003d H 2 + Cl 2 (erіtndі elektroliza i)
7. 2 H 2 O \u003d 2 H 2 + O 2 (elektroliza)
8. Ca + H 2 \u003d CaH 2
9. Ca(OH)2 + Cl2 = CaOCl2 + H2O (0ºC-de)
10. 6Ca(OH)2 + 6Cl2 = 5CaCl2 + Ca(ClO3)2 + 6H2O ( kyzdyrgan kezde)
11. Cl2 + H2O = HCl + HClO (0ºC -de)
12. 3Cl2 + 3H2O = 5HCl + HClO3 (kyzdyrgan kezde)
Zadanie 4.
Mieszanina gazowa zawierająca dwa halogenki wodoru ma gęstość wodoru 38. Objętość tej mieszaniny przy n. tak. został wchłonięty przez równą objętość wody. Do zobojętnienia 100 ml otrzymanego roztworu użyto 11,2 ml 0,4 mol/l roztworu wodorotlenku sodu.
1. Określ, które halogenki wodoru mogą być zawarte w tej mieszaninie.
2. Oblicz skład mieszanki gazowej w procentach objętościowych.
3. Zaproponuj metodę określania składu jakościowego mieszaniny gazowej.
Rozwiązanie.
1. Masa 1 mola mieszaniny gazów przy n. tak. wynosi 38 2 \u003d 76 g. Zatem mieszanina gazów nie może być obecna jednocześnie HBr i HI ( m(HBr) \u003d 81 g / mol, m(HEJ ) = 128 g/mol). Nie mogą też być obecni w tym samym czasie. HF i HCl ( m(HF) = 20 g/mol, m(HCl ) = 36,5 g/mol). Mieszanina musi zawierać halogenek wodoru zmmniej niż 76 g/mol i halogenek wodoru zmponad 76 g/mol. Możliwe składy mieszanek: 1) HF i HBr; 2) HF i HI; 3) HCl i HBr; 4) HCl i HI.
Stężenie halogenowodorów w roztworze wynosi (11,2 0,4): 100 = 0,0448 mol/l. Wartość ta całkiem dobrze odpowiada wartości obliczonej 1:22,4 = 0,0446 mol/l dla procesu rozpuszczania 1 litra gazu (n.d.) w 1 litrze wody (pod warunkiem, że cząsteczki halogenowodoru są monomeryczne). Mieszanina gazowa nie zawiera zatem fluorowodoru, który również występuje w fazie gazowej w postaci ( HF ) n , gdzie n = 2-6.
Wtedy tylko dwa warianty mieszanin odpowiadają warunkom problemu: HCl + HBr lub HCl + HI.
2. Dla mieszaniny HCl + HBr: niech x kret - ilość HCl w 22,4 litrach mieszaniny (nie dotyczy). Następnie kwota HBr wynosi (1-x ) mol. Masa 22,4 litra mieszanki to:
36,5x + 81(1-x) = 76; x = 0,112; 1-x=0,888.
Skład mieszaniny: HCl - 11,2%, HBr - 88,8%.
Podobnie dla mieszanki HCl+HI:
36,5x + 128(1-x) = 76; x = 0,562.
Skład mieszaniny: HCl - 56,2%, HI - 43,8%
3. Ponieważ obie mieszaniny muszą zawierać chlorowodór, pozostaje jakościowe określenie bromowodoru lub jodowodu. Ta definicja jest wygodniejsza do wykonania w postaci prostych substancji - bromu lub jodu. Aby przekształcić halogenki wodoru w proste substancje, wodny roztwór można utlenić chlorem:
2HBr + Cl2 = 2HCl + Br2
2HI + Cl2 = 2HCl + I2
Powstałe roztwory halogenowe można odróżnić po kolorze roztworu w rozpuszczalniku niepolarnym (podczas ekstrakcji) lub po bardziej czułej reakcji barwnej skrobi.
Ponadto oryginalne halogenki wodoru można odróżnić od innego koloru halogenków srebra:
HBr + AgNO 3 = AgBr ↓ + HNO 3 (jasnożółty osad)
HI + AgNO 3 = AgI ↓ + HNO 3 (żółty osad)
Tak 4.
Eki halogensutekten turatyn gaz kospasynyn sutek boyinsha tygyzdygy 38. Osy kospanyn қ.zh. Alyngan 100 ml eritindin beitaraptaganda 11,2 ml 0,4 mol/l sodu hydroksydinina eritindisi jumsalda.
1. Osy kospada kandai halogensutek baryn anyktanyzdar.
2. Gaz kospasynyn құramyn kolemdіk percentpen anyқtaңyzdar.
3. Gaz kospasynyn sapasyn anyktaytyn zhagdaydy usynynyzdar.
Szeszui.
1. 1 mol gazu kospasynyn massasy қ.zh. kurajdy: 38 2 \u003d 76 g. m(HBr) = 81 g/mol, m(HI) = 128 g/mol) bola almaida. Sonymen katar bіr mezgіlde HF jane HCl ( m(HF) = 20 g/mol, m(HCl) = 36,5 g/mol) bola almaida. Kosapada M massasy 76g/moldan az halogensutek bolusy kerek. Kospalary gazowe Mүmkina bolatyn: 1) HF i HBr; 2) HF zamiast HI; 3) HCl zamiast HBr; 4) HCl zamiast HI.
Stężenia erytindidegi halosutekterdyny (11,2 0,4): 100 = 0,0448 mol/l. Bulman 1 litr suғa (halogensutec cząsteczki monomery bulgan zhagdaida) 1 litr gazu (қ.zh.) erіtu proces үshіn tөmendegi esepteu nәtizhesіne zhақyn: 1:22,4 = 0,0446 mol/l. Endesze, gaz cospasynda fluorosutek bolmaidy, sebiol gaz fazasynda (HF)n turinde bolada, mundagy n = 2-6.
Endeshe eseptin sharty tek ekі nuskaga seykes keledi: HCl + HBr nemese HCl + HI.
2. HCl + HBr kospasy ushіn: 22,4 l kospadagy (қ.zh.) HCl mały - x. Onda HBr młodszy (1-x) kret boladowy. Masa kospanyńska 22,4 l:
36,5x + 81(1-x) = 76; x = 0,112; 1-x=0,888.
Kospa kuramy: HCl - 11,2%, HBr - 88,8%.
Kospa Ushin HCl+HI:
36,5x + 128(1-x) = 76; x = 0,562.
Kospa kuramy: HCl - 56,2%, HI - 43,8%
3. Wydaje się, że Endeshe bromsutek zhane iodsutek ekі kospa da boluy. Bul anyktama zhai zat turinde - brom nemese iod anyktauga yngayly. Halogensutekti zhai zatka aynaldyru ushіn onyn erіtіndіsіn chlormen totyқtyru kazhet:
2HBr + Cl2 = 2HCl + Br2
2HI + Cl2 = 2HCl + I2
Halogenderdin alyngan erіtіndіlerіn niepolarny erіtkіshtegі erіtіndinіnіn tүsі boyinsha (wydobycie kezіndegi) nemese starchdyn aserі arkyly anyқtauға bolady.
Sondai-aқ halosutekterdi kүmіs halogenidіndegi әrtүrlі tusterі arkyly anқtauғa boladas:
HBr + AgNO3 = AgBr↓ + HNO3 (aszyk-sary tunba)
HI + AgNO3 = AgI↓ + HNO3 (sary tunba)
Zadanie 5 (Obliczenia termochemiczne, zanieczyszczenia).
Podczas spalania 1,5 g próbki cynku uwolniono 5,9 kJ ciepła. Określ, czy próbka cynku zawierała niepalne zanieczyszczenia, jeśli wiadomo, że podczas spalania 1 mola cynku uwalniane jest 348 kJ ciepła.
Esep5 ( Kospalar, tyermochemiayalyk esepteuler). 1,5 grama myrysh үlgisіn zhakanda 5,9 kJ zhylu bolіndі. 1 mol myryshty zhakanda 348 kJ zhylu bөlіnetinіn bіle otyryp myrysh үlgisіnde zhanbaityn қospalar barma, zhқpa anyқtaңyzdar.
Rozwiązanie:
Szeszui:
CHEMIA
Wyjście
Ćwiczenie 1.
Rozszyfruj łańcuch przemian i przeprowadź reakcje chemiczne:
 |
pozycja:bezwzględna; z-index:2;margin-lewy:218px;margin-top:91px;width:16px;height:55px">
 |
Dodatkowo znane:
Substancja A– korund
Substancjab- najpowszechniejszy metal (Ja) w skorupie ziemskiej
Substancja C- związek zawierający 15,79% Me, 28,07% S, 56,14% O
Substancja E- biała, galaretowata substancja, słabo rozpuszczalna w wodzie. Produkt oddziaływania substancji C z alkaliami
SubstancjaD- sól sodowa najpopularniejszego metalu, której cząsteczka zawiera 40 elektronów.
Rozwiązanie:
A - Al 2 O 3
B-Al
C - Al2(SO4)3
D - NaAlO2
E – Al(OH)3
Za każdą konkretną formułę substancji - 1 punkt
Za każde poprawnie napisane równanie reakcji chemicznej (z warunkami realizacji) - 2 punkty
SUMA: 5 1+8 2 = 21 punktów
1 tapsirma.
Ainalular tizbegin ashyp, reakcja chemiczna tendeulerin zhazynyzdar:
 |
pozycja:bezwzględna; z-index:15;margin-lewy:218px;margin-top:91px;width:16px;height:55px">
 |
Kosymsha Belgili Bułgarzy:
ALEzaty– korund
bzaty– zher sharynda en köp taralgan metal (ja)
OD zaty - 15,79% Me, 28,07% S, 56,14% O turatyn kosylys
mi zaty - ak koimalzhyn zat, nasze sądy eridi. Zattyn siltimen әrekettesuinіnіn өnіmi С
D– en köp taralgan metaldyn asy sodu, cząsteczki 40 elektronna turada.
Szeszui:
A - Al2O3
B-Al
C - Al2(SO4)3
D - NaAlO2
E – Al(OH)3
Әrbіr zattyn formulasyn anyktaғanga - 1 ұpaydan
Durys zhazylgan әrbіr chemiyalyk reakcja tendeuine (sharty korsetilgen) – 2 ұpaydan
BARLYGY: 5 1 + 8 2 \u003d 21 upay
Zadanie 2.Sześć numerowanych zlewek (zlewek) zawiera ciała stałe (w postaci proszków): wodorowęglan sodu, chlorek sodu, siarczan cynku, fosforan potasu, węglan wapnia, siarczan żelaza ( II ). Używając odczynników i sprzętu na stole, określić zawartość każdej fiolki (zlewki). Podaj wzór chemiczny każdej substancji i napisz równania przeprowadzonych reakcji chemicznych.
Odczynniki: 2 M HCl, 2 M NaOH, H2O destylowany, roztwór 2M AgNO3
Sprzęt:statyw z probówkami (7-10 sztuk), szpatułką, pipetami.
Rozwiązanie:
Etapy pracy | Obserwacje | Równania reakcji, wnioski |
|
Rozpuścić próbki substancji w wodzie | Jedna substancja nie rozpuściła się | To jest CaCO3 |
|
Dodaj rozpuszczoną i nierozpuszczoną materię do próbek HCl | Gaz uwalniany jest w dwóch probówkach. | NaHCO3 + HCl = CaCO3 + HCl = |
|
Dodać roztwór wodorotlenku sodu do próbki substancji (nie nadmiaru) | W dwóch probówkach osady są zielone (bagno) i białe bezpostaciowe. | Są to FeSO4 i Zn(NO3)2 FeSO4 + NaOH = Zn(NO3)2 + NaOH= |
|
Dodaj kroplę po kropli azotanu srebra do próbek | W dwóch probówkach wypadają białe, zsiadłe i żółte osady. | Są to NaCl i K3PO4 NaCl + AgNO3 = K3PO4 + AgNO3= |
Za definicję każdej substancji 1 pkt.
Dla równania reakcji - 2 punkty
Razem: 6 1+6 2 = 18 punktów
Uwaga: Jeśli wszystkie współczynniki nie są umieszczone w równaniu reakcji, ale odzwierciedlona jest istota reakcji chemicznej - 1 punkt
2 razy.Alty nomerlengen byukste (szkło chemiczne) sztabka katty zat (ұntak turinde): wodorowęglany sodu, chlorek sodu, siarczany myryshu, fosforany potasu, węglany wapnia, siarczany temir (II). Stoldagy reaktivterdi zhane kuraldardy paydalana otyryp, arbir byukstegi zatty anyқtaңyzdar. Әrbіr zattyn chemiyalyk formulasyn zhane himiyalyk reakcja tendeulerin zhazynyzdar.
Odczynnik:2M HCl, 2M NaOH, destylacja H2O, 2M AgNO3 eritindis
ral-zhabdyқtar: bar probirkalny statyw (7-10 dan), szpatułka (ұstagysh), alar do pipety.
Szeszui:
Żymys etapary | Kubyłys | Reakcja Tendeulera |
|
Zattyn syn murarzy dworu eritu | Bir zat ta erigen zhok | Byk CaCO3 |
|
Yerigen zhane erimegen zattyn syn masyn NSI kosu | Gaz z probówki Eki bөlinedі | NaHCO3 + HCl = CaCO3 + HCl = |
|
Zattyn syna matki, syna hydroksydyny sodu kosu (az molsherde) | Ekі prrobirkada zhasyl tusti (saz balshyқ tәrіzdі) zhane ak tusti amorty tunba payda bolada | Byk FeSO4 i Zn(NO3)2 FeSO4 + NaOH = Zn(NO3)2 + NaOH= |
|
Synamaga tamshylatyp kүmis nitratyn қosamyz | Ekі probówka jako іrіmshіk tәrіzdі zhane sary tұnba tүsedі. | Bul NaCl zhane K3PO4 NaCl + AgNO3 = K3PO4 + AgNO3= |
Arbir zatty anyktaganga 1 ұpaydan.
Reakcja Arbir tendeuine - 2 ұpaydan.
Barlygy: 6 1+6 2 = 18Upay
Eskertu: Yeger tendeuinde barlyk współczynnik reakcji koyylmagan bolsa, biraq chemiyialik reakcja mani anyқtalgan bolsa – 1 ұpay beruge bolada
PRACA PRAKTYCZNA (1 godz.) Klasa 8
Praca wykonywana jest przez uczniów samodzielnie pod kierunkiem prowadzącego.
Oferuję efekt mojej wieloletniej pracy nad przygotowaniem i prowadzeniem pracy praktycznej w szkole ogólnokształcącej na lekcjach chemii w klasach 8-9:
- Pozyskiwanie i właściwości tlenu,
- „Przygotowywanie roztworów soli o określonym ułamku masowym rozpuszczonej substancji”,
- „Uogólnienie informacji o najważniejszych klasach związków nieorganicznych”,
- „Dysocjacja elektrolityczna”,
- „Podgrupa tlenowa” (patrz kolejny numer gazety „Chemia”).
Wszystkie są przeze mnie testowane w klasie. Mogą być stosowane w nauce szkolnego kursu chemii zarówno według nowego programu OS Gabrielyana, jak i według programu G.E. Rudzitisa, F.G. Feldmana.
Eksperyment studencki to rodzaj samodzielnej pracy. Eksperyment nie tylko wzbogaca uczniów o nowe koncepcje, umiejętności, umiejętności, ale także jest sposobem na zweryfikowanie prawdziwości zdobytej wiedzy, przyczynia się do głębszego zrozumienia materiału, przyswojenia wiedzy. Pozwala pełniej realizować zasadę zmienności w postrzeganiu otaczającego świata, ponieważ główną istotą tej zasady jest związek z życiem, z przyszłą działalnością praktyczną uczniów.
Cele. Umieć odbierać tlen w laboratorium i pobierać go dwoma metodami: wypieraniem powietrza i wypieraniem wody; potwierdzić doświadczalnie właściwości tlenu; znać zasady bezpieczeństwa.
Sprzęt. Stojak metalowy ze stopką, lampka spirytusowa, zapałki, probówka z rurką wylotową gazu, probówka, wacik, pipeta, zlewka, drzazga, igła (lub drut) preparacyjna, krystalizator z wodą, dwie kolby stożkowe z korkami.
Odczynniki. KMnO 4 krystaliczny (5–6 g), Ca (OH) 2 woda wapienna, węgiel drzewny,
Fe (drut stalowy lub spinacz do papieru).
Zasady bezpieczeństwa.
Ostrożnie obchodzić się ze sprzętem chemicznym!
Pamiętać! Probówkę ogrzewa się, trzymając ją w pozycji pochylonej, na całej jej długości dwoma lub trzema ruchami w płomieniu lampy alkoholowej. Podczas ogrzewania kieruj otwór probówki z dala od siebie i sąsiadów.
Wcześniej uczniowie otrzymują prace domowe związane z przestudiowaniem treści nadchodzącej pracy zgodnie z instrukcją, jednocześnie korzystając z materiałów podręczników ósmej klasy O.S. Gabrielyana (§ 14, 40) lub G.E. Rudzitisa, F.G. Feldmana (§ 19, 20). W zeszytach do pracy praktycznej spisują nazwę tematu, cel, wymieniają sprzęt i odczynniki, sporządzają tabelę do raportu.
PODCZAS ZAJĘĆ
Jedno doświadczenie stawiam wyżej
niż tysiąc opinii
tylko urodzony
wyobraźnia.
M.V. Lomonosov
Pozyskiwanie tlenu
metoda wypierania powietrza
(10 minut)
1. Nadmanganian potasu (KMnO 4) umieścić w suchej probówce. Umieść luźną kulkę waty w otworze probówki.
2. Zamknąć probówkę korkiem z rurką wylotową gazu, sprawdzić szczelność (rys. 1).
|
Ryż. jeden.
|
(Objaśnienia nauczyciela dotyczące sprawdzania szczelności urządzenia.) Zamocuj urządzenie w nodze statywu.
3. Opuść rurkę wylotową gazu do szyby, nie dotykając dna, na odległość 2-3 mm (rys. 2).
4. Rozgrzej substancję w probówce. (Pamiętaj o przepisach bezpieczeństwa.)
5. Sprawdź obecność gazu za pomocą tlącego się drzazgi (węgiel drzewny). Co oglądasz? Dlaczego tlen można zbierać przez wypieranie powietrza?
6. Zbierz powstały tlen do dwóch kolb do kolejnych eksperymentów. Zamknąć kolby korkami.
7. Przygotuj raport korzystając z tabeli. 1, którą umieszczasz na rozkładówce swojego notatnika.
Pozyskiwanie tlenu
metoda wypierania wody
(10 minut)
1. Napełnij probówkę wodą. Zamknij tubkę kciukiem i odwróć ją do góry nogami. W tej pozycji opuść rękę z probówką do krystalizatora z wodą. Doprowadzić probówkę do końca rurki wylotowej gazu bez wyjmowania jej z wody (rys. 3).
2. Gdy tlen wypchnie wodę z rurki, zamknij ją kciukiem i wyjmij z wody. Dlaczego tlen można zbierać poprzez wypieranie wody?
Uwaga! Wyjąć rurkę wylotową gazu z krystalizatora, kontynuując ogrzewanie rurki za pomocą KMnO 4 . Jeśli tego nie zrobisz, woda zostanie wrzucona do gorącej probówki. Czemu?
Spalanie węgla w tlenie
(5 minut)
1. Zamocuj węgiel na metalowym drucie (igła preparacyjna) i włóż go w płomień lampy alkoholowej.
2. Opuść rozgrzany węgiel do kolby z tlenem. Co oglądasz? Podaj wyjaśnienie (rysunek 4).
3. Po wyjęciu niespalonego węgla z kolby wlej do niej 5-6 kropli wody wapiennej
Ca(OH)2. Co oglądasz? Podaj wyjaśnienie.
4. Wydaj raport z pracy w tabeli. jeden.
Płonący drut stalowy (żelazny)
w tlenie
(5 minut)
1. Przymocuj kawałek zapałki do jednego końca stalowego drutu. Zapal zapałkę. Zanurz drut z płonącą zapałką w kolbie z tlenem. Co oglądasz? Podaj wyjaśnienie (rysunek 5).
2. Wydaj raport z pracy w tabeli. jeden.
Tabela 1
| Operacje w toku (co oni robili) |
Liczby z oznaczeniami substancji wyjściowych i otrzymanych | Obserwacje. Warunki przeprowadzanie reakcji. równania reakcji |
Wyjaśnienia obserwacji. wnioski |
|---|---|---|---|
| Montaż urządzenia do pozyskiwania tlenu. Sprawdzenie urządzenia pod kątem wycieków | |||
| Pozyskiwanie tlenu od KMnO 4 po podgrzaniu |
|||
| Dowód produkcji tlenu z tlący się drzazga |
|||
| Charakterystyka właściwości fizycznych O 2. Zbieranie O 2 dwoma metodami: wyporność powietrza, wyporność |
|||
| Charakterystyka właściwości chemiczne O 2. Interakcja z prostymi substancjami spalanie węgla, palenie żelaza (drut stalowy, spinacz do papieru) |
Sporządź pisemny ogólny wniosek dotyczący wykonanej pracy (5 min).
WYJŚCIE. Jednym ze sposobów pozyskiwania tlenu w laboratorium jest rozkład KMnO 4 . Tlen jest bezbarwnym i bezwonnym gazem, 1,103 razy cięższym od powietrza ( Pan(O 2) \u003d 32, Pan(powietrze) \u003d 29, z czego wynika 32/29 1,103), słabo rozpuszczalny w wodzie. Reaguje z prostymi substancjami tworząc tlenki.
Uporządkuj miejsce pracy (3 min): zdemontuj urządzenie, ułóż naczynia i akcesoria na swoich miejscach.
Prześlij swoje notatniki do recenzji.
Praca domowa.
Zadanie. Określ, który ze związków żelaza - Fe 2 O 3 lub Fe 3 O 4 - jest bogatszy w żelazo?
| Dany: | Znaleźć: |
| Fe 2 O 3, Fe 3 O 4 . |
(Fe) w Fe 2 O 3, „(Fe) do Fe 3 O 4 |
Rozwiązanie
(X) = n A r(X)/ Pan, gdzie n- liczba atomów pierwiastka X we wzorze substancji.
Pan(Fe 2 O 3) \u003d 56 2 + 16 3 \u003d 160,
(Fe) \u003d 56 2/160 \u003d 0,7,
(Fe) = 70%,
Pan(Fe 3 O 4) \u003d 56 3 + 16 4 \u003d 232,
„(Fe) \u003d 56 3/232 \u003d 0,724,
„(Fe) = 72,4%.
Odpowiedź. Fe 3 O 4 jest bogatszy w żelazo niż Fe 2 O 3 .
W trakcie pracy praktycznej nauczyciel monitoruje poprawność wykonania technik i operacji przez uczniów oraz zapisuje w karcie ewidencji umiejętności (tab. 2).
Tabela 2
Karta rekordu umiejętności
| Operacje praktycznej pracy | Nazwiska uczniów | |||||
|---|---|---|---|---|---|---|
| ALE | b | W | g | D | mi | |
| Montaż urządzenia do pozyskiwania tlenu | ||||||
| Sprawdzenie urządzenia pod kątem wycieków | ||||||
| Mocowanie probówki w nodze statywu | ||||||
| Obsługa lampy alkoholowej | ||||||
| Ogrzewanie probówki z KMnO 4 | ||||||
| Sprawdzanie uwalniania O 2 | ||||||
| Zbieranie O 2 w naczyniu dwoma metodami: wyporność powietrza, wyporność |
||||||
| spalanie węgla | ||||||
| Spalanie Fe (drut stalowy) | ||||||
| Kultura eksperymentalna | ||||||
| Wykonywanie pracy w zeszycie | ||||||
Przykładowy raport z wykonanej pracy praktycznej (tabela 1)
tlący się drzazga
(węgiel) świeci jasno
w O 2
właściwości fizyczne O 2. Zbieranie O 2 dwoma metodami:
wyporność powietrza (a),
wyporność (b)

nieco cięższy od powietrza, więc
zbiera się go w naczyniu umieszczonym na dnie. Tlen jest słabo rozpuszczalny w wodzie


Woda wapienna staje się mętna, ponieważ tworzy się nierozpuszczalny w wodzie osad CaCO 3 :
CO 2 + Ca (OH) 2 CaCO 3 + H 2 O. Żelazo pali się jasnym płomieniem w tlenie:

z prostym
substancje - metale i niemetale. Powstanie białego osadu potwierdza obecność CO 2 w kolbie