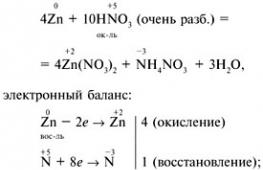Hapniku saamine ja omadused. Gaasilised ained anorgaanilises ja orgaanilises keemias Gaasi saab koguda õhu väljatõrjumise meetodil
Test "Lämmastik ja selle ühendid"
valik 1 1. Tugevaim molekul a) H2; b) F2; c) O2; d) N2. 2. Fenoolftaleiini värvus ammoniaagilahuses: a) karmiinpunane; b) roheline; c) kollane; d) sinine. 3. Oksüdatsiooniaste on ühendi lämmastikuaatomi juures +3: a) NH 4 NO 3; b) NaNO3; c) NO2; d) KNO 2. 4. Vask(II)nitraadi termilisel lagunemisel moodustuvad:a) vask(II)nitrit ja O 2 b) lämmastikoksiid (IV) ja O 2 c) vask(II)oksiid, pruun gaas NO 2 ja O2; d) vask(II)hüdroksiid, N 2 ja O 2. 5. Millise iooni moodustab doonor-aktseptor mehhanism? a) NH4+; b) NO3-; c) Cl-; d) SO 4 2–. 6. Määrake tugevad elektrolüüdid: a) lämmastikhape; b) dilämmastikhape; c) ammoniaagi vesilahus; d) ammooniumnitraat. 7. Koostoime käigus eraldub vesinik: a) Zn + HNO3 (rasb.); b) Cu + HCl (lahus), c) Al + NaOH + H 2 O d) Zn + H 2 SO 4 (rasb.), e) Fe + HNO 3 (konts.). 8. Kirjutage võrrand tsingi ja väga lahjendatud lämmastikhappe reaktsiooni kohta, kui üks reaktsiooniproduktidest on ammooniumnitraat. Määrake koefitsient oksüdeeriva aine ees. 9.Nimetage ained A, B, C. 2. variant 1. Vee väljatõrjumise meetodil on võimatu koguda: a) lämmastikku; b) vesinik; c) hapnik; d) ammoniaak. 2. Ammooniumioonide reaktiiv on lahus, mis koosneb: a) kaaliumsulfaadist; b) hõbenitraat; c) naatriumhüdroksiid; d) baariumkloriid. 3. HNO-ga suheldes 3 (konts.) gaas moodustub vaselaastudega: a) N20; b) NH3; c) NO2; d) H2. 4. Naatriumnitraadi termiline lagunemine annab: a) naatriumoksiid, pruun gaas NO 2, O 2; b) naatriumnitrit ja O 2; c) naatrium, pruun gaas NO 2, O 2; d) naatriumhüdroksiid, N 2, O 2. 5. Lämmastiku oksüdatsiooniaste ammooniumsulfaadis: a) -3; b) -1; c) +1; d) +3. 6. Milliste järgmiste ainetega kontsentreeritud HNO reageerib? 3 tavatingimustes? a) NaOH; b) AgCl; c) Al; d) Fe; e) Cu. 7. Täpsustage ioonide arv naatriumsulfaadi ja hõbenitraadi interaktsiooni lühendatud ioonvõrrandis: a) 1; b) 2; aastal 3; d) 4. 8. Kirjutage magneesiumi ja lahjendatud lämmastikhappe vastasmõju võrrand, kui üks reaktsiooniproduktidest on lihtaine. Määrake koefitsient võrrandis oksüdeeriva aine ees. 9. Kirjutage reaktsioonivõrrandid järgmiste teisenduste jaoks:
Nimetage ained A, B, C, D.
Vastused
valik 1 1 - G; 2 - aga; 3 - G; 4 - sisse; 5 - aga; 6 - a, d; 7 - c, d; 8 – 10,


2Ag + + SO 4 2– = Ag 2 SO 4;
8 – 12, 9. A - NO, B - NO 2, C - HNO 3, D - NH 4 NO 3,
Gaaside kogumine
Gaaside kogumise meetodid määravad ära nende omadused: lahustuvus ja koostoime vee, õhuga, gaasi mürgisus. Gaasi kogumiseks on kaks peamist meetodit: õhu väljatõrjumine ja vee väljatõrjumine. Õhu väljatõrjumine koguma gaase, mis ei suhtle õhuga.
Vastavalt gaasi suhtelisele tihedusele õhus tehakse järeldus, kuidas paigutada anum gaasi kogumiseks (joon. 3, a ja b).
Joonisel fig. 3a on kujutatud gaasi kogumit, mille õhutihedus on suurem kui ühik, näiteks lämmastikoksiid (IV), mille õhutihedus on 1,58. Joonisel fig. 3b on kujutatud gaasi kogumist, mille õhutihedus on väiksem kui ühik, nagu vesinik, ammoniaak jne.
Vee väljatõrjumisel kogutakse gaase, mis veega ei interakteeru ja lahustuvad selles halvasti. Seda meetodit nimetatakse gaasi kogumine vee kohal , mis viiakse läbi järgmiselt (joonis 3, c). Silinder või purk täidetakse veega ja kaetakse klaasplaadiga, et silindrisse ei jääks õhumulle. Plaati hoitakse käes, silinder pööratakse ümber ja lastakse klaasveevanni. Vee all eemaldatakse plaat, gaasi väljalasketoru viiakse silindri avatud auku. Gaas tõrjub silindrist järk-järgult vett välja ja täidab selle, misjärel suletakse vee all olev ballooni auk klaasplaadiga ja eemaldatakse gaasiga täidetud balloon. Kui gaas on õhust raskem, siis asetatakse balloon tagurpidi lauale ja kui on kergem, siis tagurpidi plaadile. Vee kohal olevad gaasid saab koguda katseklaasidesse, mis, nagu silindergi, täidetakse veega, suletakse näpuga ja kummutatakse veega klaasi või klaasvanni.
Mürgised gaasid kogutakse tavaliselt vee väljatõrjumise teel, kuna on lihtne jälgida hetke, mil gaas anuma täielikult täidab. Kui on vaja gaasi koguda õhu väljatõrjumise meetodil, siis toimige järgmiselt (joonis 3, d).
Kolbi (purki või silindrisse) sisestatakse kahe gaasi väljalasketoruga kork. Läbi ühe, mis ulatub peaaegu põhjani, lastakse sisse gaas, teise ots lastakse gaasi imava lahusega klaasi (purki). Näiteks vääveloksiidi (IV) absorbeerimiseks valatakse klaasi leeliselahus ja vesinikkloriidi absorbeerimiseks valatakse klaasi vett. Pärast kolvi (purgi) gaasiga täitmist eemaldatakse sellelt gaasi väljalasketorudega kork ja anum suletakse kiiresti korgi- või klaasplaadiga ning gaasi väljalasketorudega kork asetatakse gaasi absorbeerivasse lahusesse.
Kogemus 1. Hapniku hankimine ja kogumine
Paigaldage paigaldus vastavalt joonisele. 4. Asetage 3-4 g kaaliumpermanganaati suurde kuiva katseklaasi, sulgege gaasi väljalasketoruga korgiga. Kinnitage katseklaas riiulisse viltu nii, et ava oleks veidi ülespoole. Asetage kristallisaator veega statiivi kõrvale, millele katseklaas on kinnitatud. Täitke tühi katseklaas veega, sulgege auk klaasplaadiga ja keerake see kiiresti tagurpidi kristallisaatorisse. Seejärel võtke klaasplaat välja vees. Katseklaasis ei tohiks olla õhku. Kuumutage kaaliumpermanganaati põleti leegis. Kastke gaasi väljalasketoru ots vette. Jälgige gaasimullide ilmumist.
Mõni sekund pärast mullide eraldumise algust viige gaasi väljalasketoru ots veega täidetud katseklaasi auku. Hapnik tõrjub torust vee välja. Pärast katseklaasi hapnikuga täitmist katke selle ava klaasplaadiga ja keerake tagurpidi.
1. Milliseid laboratoorseid meetodeid hapniku saamiseks teate? Kirjutage vastavad reaktsioonivõrrandid.
2. Kirjeldage oma tähelepanekuid. Selgitage katseklaasi asukohta katse ajal.
3. Kirjutage kaaliumpermanganaadi kuumutamisel lagunemise keemilise reaktsiooni võrrand.
4. Miks süttib hõõguv kild katseklaasis koos hapnikuga?
Kogemus 2. Vesiniku tootmine metalli mõju happele
Pange kokku korgiga katseklaasist koosnev aparaat, millest läbib sissetõmmatud otsaga klaastoru (joonis 5). Katseklaasi asetada mõned tsingitükid ja lisada lahjendatud väävelhappe lahus. Sisestage kork kindlalt tagasi tõmmatud toruga, kinnitage katseklaas vertikaalselt statiiviklambrisse. Jälgige gaasi eraldumist.
Kui vesinikuga katseklaasis on õhku, toimub väike plahvatus, millega kaasneb terav heli. Sel juhul tuleks gaasi puhtuse testi korrata. Kui olete veendunud, et seadmest tuleb puhast vesinikku, süütage see tõmmatud toru ava juures.
Kontrollküsimused ja ülesanded:
1. Täpsustage vesiniku saamise ja kogumise meetodid laboris. Kirjutage vastavad reaktsioonivõrrandid.
2. Kirjutage võrrand keemilise reaktsiooni kohta vesiniku tootmiseks katsetingimustes.
3. Hoidke kuiva toru vesiniku leegi kohal. Mis aine tekib vesiniku põletamisel? Kirjutage vesiniku põlemisreaktsiooni võrrand.
4. Kuidas kontrollida katse käigus saadud vesiniku puhtust?
Kogemus 3. Ammoniaagi saamine
Kontrollküsimused ja ülesanded:
1. Milliseid lämmastiku vesinikuühendeid teate? Kirjutage nende valemid ja nimed.
2. Kirjeldage toimuvat. Selgitage katseklaasi asukohta katse ajal.
3. Kirjutage ammooniumkloriidi ja kaltsiumhüdroksiidi vahelise reaktsiooni võrrand.
Kogemus 4. Lämmastikoksiidi (IV) saamine
Pange seade kokku vastavalt joonisele. 7. Valage kolbi veidi vaselaaste, valage lehtrisse 5-10 ml kontsentreeritud lämmastikhapet. Valage hape kolbi väikeste portsjonitena. Koguge väljuv gaas katseklaasi.
Kontrollküsimused ja ülesanded:
1. Kirjeldage toimuvat. Mis värvi on väljavoolav gaas?
2. Kirjutage võrrand vase ja kontsentreeritud lämmastikhappe vastasmõju reaktsiooni kohta.
3. Millised omadused on lämmastikhappel? Millised tegurid määravad ainete koostise, milleks see redutseeritakse? Too näiteid metallide ja lämmastikhappe vahelistest reaktsioonidest, mille tulemusena on HNO 3 redutseerimise produktideks NO 2, NO, N 2 O, NH 3.
Kogemus 5. Vesinikkloriidi saamine
Asetage 15-20 g naatriumkloriidi Wurtzi kolbi; tilklehtrisse - väävelhappe kontsentreeritud lahus (joon. 8). Sisestage gaasi väljalasketoru ots vesinikkloriidi kogumiseks kuiva anumasse nii, et toru ulatuks peaaegu põhjani. Sulgege anuma ava lahtise vatipalliga.
Asetage seadme kõrvale veega kristallisaator. Valage tilklehtrist väävelhappe lahus.
Reaktsiooni kiirendamiseks soojendage kolbi veidi. Kui läbi
vatt, millega anuma ava suletakse, ilmub udu,
Kontrollküsimused ja ülesanded:
1. Selgitage vaadeldud nähtusi. Mis on udu tekkimise põhjus?
2. Milline on vesinikkloriidi lahustuvus vees?
3. Katsetage saadud lahust lakmuspaberiga. Mis on pH väärtus?
4. Kirjutage võrrand tahke naatriumkloriidi ja kontsentreeritud aine vastastikmõju keemilise reaktsiooni kohta väävelhape.
Kogemus 6. Süsinikmonooksiidi saamine ja kogumine (IV)
Installatsioon koosneb Kipp aparaadist 1 , täidetud marmoritükkidega ja vesinikkloriidhappega, kaks järjestikku ühendatud Tištšenko kolbi 2 Ja 3 (pudel 2 täidetud veega, et puhastada vesinikkloriidist ja mehaanilistest lisanditest läbivat süsinikmonooksiidi (IV), pudel 3 - väävelhape gaasi kuivatamiseks) ja kolvid 4 mahuga 250 ml süsinikmonooksiidi (IV) kogumiseks (joon. 9).
Riis. 9. Seade süsinikmonooksiidi saamiseks (IV)
Kontrollküsimused ja ülesanded:
1. Langetage põlev tõrvik süsinikmonooksiidiga (IV) kolbi ja selgitage, miks leek kustub.
2. Kirjutage vingugaasi (IV) tekke võrrand.
3. Kas süsinikmonooksiidi (IV) saamiseks on võimalik kasutada kontsentreeritud väävelhappe lahust?
4. Laske Kippi aparaadist vabanenud gaas veega katseklaasi, mis on toonitud neutraalse lakmuslahusega. Mida jälgitakse? Kirjutage üles reaktsiooni võrrandid, mis toimuvad gaasi lahustamisel vees.
Testi küsimused:
1. Loetlege aine gaasilise oleku põhiomadused.
2. Pakkuge välja gaaside klassifikatsioon 4-5 olulise tunnuse järgi.
3. Kuidas loetakse Avogadro seadust? Mis on selle matemaatiline avaldis?
4. Selgitage segu keskmise molaarmassi füüsikalist tähendust.
5. Arvutage tingimusliku õhu keskmine molaarmass, milles hapniku massiosa on 23% ja lämmastiku massiosa on 77%.
6. Milline järgmistest gaasidest on õhust kergem: süsinikoksiid (II), vingugaas (IV), fluor, neoon, atsetüleen C 2 H 2, fosfiin PH 3?
7. Määrake gaasisegu vesiniku tihedus, mis koosneb argoonist mahuga 56 liitrit ja lämmastikust mahuga 28 liitrit. Gaaside mahud on antud n.o.s.
8. Avatud anumat kuumutatakse konstantsel rõhul 17 ° C kuni 307 ° C. Milline osa õhust (massi järgi) anumas tõrjutakse välja?
9. Määrake 3 liitri lämmastiku mass temperatuuril 15 °C ja rõhul 90 kPa.
10. 982,2 ml gaasi mass temperatuuril 100 ° C ja rõhul 986 Pa on 10 g. Määrake gaasi molaarmass.
PRAKTILINE TÖÖ (1 h) 8. klass
Tööd teostavad õpilased iseseisvalt õpetaja juhendamisel.
Pakun välja oma aastatepikkuse töö tulemuse üldkoolis praktiliste tööde ettevalmistamisel ja läbiviimisel 8.–9. klassi keemiatundides:
- Hapniku saamine ja omadused,
- "Soolalahuste valmistamine lahustunud aine teatud massiosaga",
- "Teabe üldistamine kõige olulisemate anorgaaniliste ühendite klasside kohta",
- "Elektrolüütiline dissotsiatsioon",
- "Hapniku alarühm" (vt ajalehe "Keemia" järgmist numbrit).
Neid kõiki katsetan mina klassiruumis. Neid saab kasutada keemia koolikursuse õppimisel nii O.S. Gabrielyani uue programmi kui ka G.E. Rudzitise, F.G. Feldmani programmi järgi.
Õpilaskatse on iseseisva töö liik. Eksperiment mitte ainult ei rikasta õpilasi uute mõistete, oskuste, oskustega, vaid on ka viis omandatud teadmiste tõesuse kontrollimiseks, aitab kaasa materjali sügavamale mõistmisele, teadmiste omastamisele. See võimaldab teil ümbritseva maailma tajumise muutlikkuse põhimõtet täielikumalt rakendada, kuna selle põhimõtte põhiolemus on seos eluga, õpilaste tulevase praktilise tegevusega.
Eesmärgid. Oskama laboris hapnikku vastu võtta ja koguda kahel meetodil: õhuväljasurve ja veeväljasurve; kinnitada katseliselt hapniku omadusi; teadke ohutusreegleid.
Varustus. Jalaga metallist alus, piirituslamp, tikud, õhutustoruga katseklaas, katseklaas, vatipall, pipett, keeduklaas, kild, lahutusnõel (või traat), kristallisaator veega, kaks korgiga koonilisse kolbi.
Reaktiivid. KMnO 4 kristalne (5–6 g), Ca (OH) 2 lubjavesi, puusüsi,
Fe (terastraat või kirjaklamber).
Ohutusreeglid.
Käsitsege keemilisi seadmeid ettevaatlikult!
Pea meeles! Katseklaasi kuumutatakse, hoides seda kaldasendis kogu pikkuses kahe või kolme liigutusega alkohollambi leegis. Kuumutamisel suuna katseklaasi ava endast ja naabritest eemale.
Varem saavad õpilased eelseisva töö sisu uurimisega seotud kodutööd vastavalt juhendile, kasutades samaaegselt O.S.Gabrieliani (§ 14, 40) või G.E. Rudzitise, F.G.Feldmani 8. klassi õpikute materjale (§ 19 kakskümmend). Praktiliste tööde vihikutesse kirjutatakse üles teema nimetus, eesmärk, loetletakse seadmed ja reaktiivid, koostatakse ettekande tabel.
TUNNIDE AJAL
Ühe kogemuse panin kõrgemale
kui tuhat arvamust
ainult sündinud
kujutlusvõime.
M.V. Lomonosov
Hapniku saamine
õhu väljatõrjumise meetod
(10 min)
1. Kaaliumpermanganaat (KMnO 4) asetage kuiva katseklaasi. Asetage katseklaasi avasse lahtine vatipall.
2. Sulgege katseklaas gaasi väljalasketoruga korgiga, kontrollige tihedust (joonis 1).
|
Riis. üks.
|
(Õpetaja selgitused seadme lekete kontrollimiseks.) Kinnitage seade statiivi jalga.
3. Langetage gaasi väljalasketoru 2–3 mm kaugusel põhja puudutamata klaasi sisse (joonis 2).
4. Soojendage aine katseklaasis. (Pidage meeles ohutusnõudeid.)
5. Kontrollige gaasi olemasolu hõõguva killu (süsi) abil. Mida sa vaatad? Miks saab hapnikku koguda õhu väljatõrjumise teel?
6. Koguge saadud hapnik kahte kolbi järgmiste katsete jaoks. Sulgege kolvid korkidega.
7. Koostage tabeli abil aruanne. 1, mille asetate oma märkmiku levialale.
Hapniku saamine
veeväljasurve meetod
(10 min)
1. Täitke katseklaas veega. Sulgege toru pöidlaga ja keerake see tagurpidi. Selles asendis langetage käsi koos katseklaasiga veega kristallisaatorisse. Tooge katseklaas gaasi väljalasketoru otsa, ilma seda veest eemaldamata (joonis 3).
2. Kui hapnik on vee torust välja surunud, sulgege see pöidlaga ja eemaldage see veest. Miks saab hapnikku koguda vee väljatõrjumisega?
Tähelepanu! Eemaldage gaasi väljalasketoru kristallisaatorist, jätkates toru kuumutamist KMnO 4 -ga. Kui seda ei tehta, visatakse vesi kuuma katseklaasi. Miks?
Söe põletamine hapnikus
(5 minutit)
1. Kinnitage kivisüsi metalltraadile (lahkamisnõel) ja viige see alkohollambi leeki.
2. Laske tulikuum kivisüsi hapnikuga kolbi. Mida sa vaatad? Andke selgitus (joonis 4).
3. Pärast põlemata söe kolvist väljavõtmist valage sinna 5-6 tilka lubjavett
Ca(OH)2. Mida sa vaatad? Andke selgitus.
4. Tabelis tehtud töö kohta väljastada aruanne. üks.
Põlev teras (raud) traat
hapnikus
(5 minutit)
1. Kinnitage tikutükk terastraadi ühte otsa. Süüta tikk. Kastke traat koos põleva tikuga hapnikuga kolbi. Mida sa vaatad? Andke selgitus (joonis 5).
2. Tabelis tehtud töö kohta väljastada aruanne. üks.
Tabel 1
| Toimingud pooleli (mida nad tegid) |
Joonised algsete ja saadud ainete tähistustega | Tähelepanekud. Tingimused reaktsioonide läbiviimine. Reaktsioonivõrrandid |
Vaatluste selgitused. järeldused |
|---|---|---|---|
| Seadme kokkupanek hapniku saamiseks. Seadme lekete kontrollimine | |||
| Hapniku saamine kuumutamisel KMnO 4-st |
|||
| Hapniku tootmise tõend koos hõõguv kild |
|||
| O 2 füüsikaliste omaduste tunnused. O2 kogumine kahel viisil: õhu väljatõrjumine, veeväljasurve |
|||
| Iseloomulik O2 keemilised omadused. Interaktsioon lihtsate ainetega põlev kivisüsi, põlev raud (terastraat, kirjaklamber) |
Tee kirjalik üldjäreldus tehtud töö kohta (5 min).
VÄLJUND. Üheks võimaluseks laboris hapniku saamiseks on KMnO 4 lagundamine. Hapnik on värvitu ja lõhnatu gaas, õhust 1,103 korda raskem ( Härra(O 2) \u003d 32, Härra(õhk) \u003d 29, millest järgneb 32/29 1,103), vees kergelt lahustuv. See reageerib lihtsate ainetega, moodustades oksiide.
Seadke töökoht korda (3 min): võtke seade lahti, asetage nõud ja tarvikud oma kohale.
Esitage oma märkmikud ülevaatamiseks.
Kodutöö.
Ülesanne. Tehke kindlaks, milline rauaühenditest - Fe 2 O 3 või Fe 3 O 4 - on rauarikkam?
| Antud: | Leidma: |
| Fe2O3, Fe304. |
(Fe) Fe2O3-s, "(Fe) kuni Fe 3 O 4 |
Lahendus
(X) = n A r(X)/ Härra, kus n- elemendi X aatomite arv aine valemis.
Härra(Fe 2 O 3) \u003d 56 2 + 16 3 \u003d 160,
(Fe) \u003d 56 2/160 \u003d 0,7,
(Fe) = 70%
Härra(Fe 3 O 4) \u003d 56 3 + 16 4 \u003d 232,
"(Fe) \u003d 56 3/232 \u003d 0,724,
"(Fe) = 72,4%.
Vastus. Fe 3 O 4 on rauarikkam kui Fe 2 O 3 .
Praktilise töö käigus jälgib õpetaja õpilaste võtete ja toimingute sooritamise õigsust ning märgib oskuste arvestuskaardile (tabel 2).
tabel 2
Oskuste arvestuskaart
| Praktilise töö operatsioonid | Õpilaste perekonnanimed | |||||
|---|---|---|---|---|---|---|
| AGA | B | IN | G | D | E | |
| Seadme kokkupanek hapniku saamiseks | ||||||
| Seadme lekete kontrollimine | ||||||
| Katseklaasi kinnitamine statiivi jalga | ||||||
| Alkohollampide käsitsemine | ||||||
| Katseklaasi kuumutamine KMnO 4-ga | ||||||
| O2 vabanemise kontrollimine | ||||||
| O 2 kogumine anumasse kahel viisil: õhu väljatõrjumine, veeväljasurve |
||||||
| kivisöe põletamine | ||||||
| Fe (terastraadi) põletamine | ||||||
| Eksperimentaalne kultuur | ||||||
| Töö tegemine märkmikusse | ||||||
Näidisaruanne tehtud praktilisest tööst (tabel 1)
hõõguv kild
(süsi) süttib eredalt
O 2-s
O2 füüsikalised omadused. O2 kogumine kahel viisil:
õhuväljasurve (a),
veeväljasurve (b)

õhust veidi raskem, seega
see kogutakse põhja asetatud anumasse. Hapnik lahustub vees vähe


Lubjavesi muutub häguseks, kuna moodustub vees lahustumatu CaCO 3 sade:
CO 2 + Ca (OH) 2 CaCO 3 + H 2 O. Raud põleb hapnikus ereda leegiga:

lihtsaga
ained - metallid ja mittemetallid. Valge sademe moodustumine kinnitab CO 2 olemasolu kolvis
KEEMIA
Järeldus
1. ülesanne.
Gaasilised ained on antud: H2, HCl, CO2, CO, O2, NH3.
1. Tee kindlaks, millised neist on õhust kergemad ja millised raskemad (põhjenda vastust).
2. Määrake, milliseid neist ei saa veeväljasurve abil koguda.
3. Tehke kindlaks, mis juhtub nende gaasidega, kui need lastakse läbi happe, leelise lahuse (kinnitage vastus reaktsioonivõrranditega).
Lahendus.
1. Õhust kergemad need, mille molaarmass on alla 29 g/mol (õhu molaarmass). See H2, CO, NH3. Raskemad: HCl, CO 2, O 2.
2. Veeväljasurve meetod võib koguda vees lahustumatud või halvasti lahustuvad gaasid. See H 2, CO 2, CO, O 2 . Gaase on võimatu koguda vee väljatõrjumisega: HCl, NH3.
3. Aluseliste omadustega ained reageerivad hapetega:
NH3 + HCl = NH4Cl
Happeliste omadustega ained reageerivad leelistega:
HCl + KOH = KCl + H2O
Esep 1.
Gaas tarizdі zattar berіlgen: H2, HCl, CO2, CO, O2, NH3.
1.Olardyn kaysysy auadan auyr zhane kaysysy zhenіl ekenіn anyқtaңyzdar (zhauaptaryңyzdy deleldenіzder).
2. Olardyn kaysysyn kohtud ygystyru adіsimen anyktauga bolmaytynyn anyktanyzdar.
3. Yeger olardy sіltinіn, қyshқyldyң erіtіndіlerі аrkyly өtkіzgende osy gazdarmen ne bolatynyn anyktaңyzdar (zhauaptaryңіліныдырды).
Sheshui.
1. Auadan zhenil, yagni molyarlyk massasy 29 g/moldan (auanyn molyarlyk massasy) kishi bolatyn gasdar: H2, CO, NH3. Alus: HCl, CO2, O2.
2. Kohtud yғgystyru adіsimen of the Court of erіmeitіn nemese of the Court of az eritіn gazdardy aluga bolady. Olar See on H2, CO2, CO, O2. Kohtud ygystyru adіsi arkyly zhinauga bolmaityn gazdar: HCl, NH3.
3. Қyshқylmen negіzdіk қasiet korsetetіn zattar аrekettesedі:
NH3 + HCl = NH4Cl
Sіltіlermen қyshқyldyқ қasiet kөrsetetіn zattar аrekettesedі:
HCl + KOH = KCl + H2O
CO2 + 2KOH = K2CO3 + H2O või CO2 + KOH = KHCO3
2. ülesanne.
Varakevadel, varahommikul, kui ümbritsev temperatuur oli veel 0 °C ja rõhk 760 mm Hg. Art., kolm seltsimeest, kes jalutasid oma koertega, nägid murul tühja pudelit. "See on tühi," ütles üks neist. "Ei, see on ääreni täis ja ma tean selle kraami valemit, millega see on täidetud," ütles teine. "Te mõlemad eksite," ütles kolmas.
1. Kellel seltsimeestest oli sinu arvates õigus (põhjenda vastust)?
2. Arvutage pudelis sisalduva aine kogus ja osakeste arv, kui selle maht on 0,7 dm3.
3. Arvutage pudelis sisalduva gaasi molaarmass.
Lahendus.
1. Kolmas on õige, kuna pudelis on õhku (ei ole tühi - esimene on vale), ja õhk ei ole üksikaine (teine on ka vale). Õhk on gaaside segu:
2. Kuna tingimused on normaalsed, siisV M = 22,4 l/mol. Arvutage aine kogusn = V / V M \u003d 0,7 / 22,4 l / mol \u003d 0,03125 mol. Osakeste arvN = N A n\u003d 6,02 1023 mol-1 0,03125 mol \u003d 1,88 1022 osakest.
3. Õhu molaarmassi saab arvutada, teades õhu koostist. Õhk sisaldab ligikaudu 78% N2, 21% O2, 0,5% Ar ja 0,5% CO2 . Keskmine molaarmass on võrdneM vrd = xüks · M 1 + x 2 · M 2 + x 3 · M 3 + x 4 · M 4
Esep 2.
Erte koktemde tanerten erte korshagan ortanyn temperatuur sy 0 °C, küsim 760 mm son. viga. bolyp turgan kezde ush adam ozderinin ytterin kydyrtuғa shykty zhane olar gasondagy bos құtyny (pudel) kөrdі. "Ol boss" - vanaisa onyn bireui. “Joq, auzina deyin zattarmen toly” vanaisa ekіnshіsi, sebi ol kutynyң ishіndegі zattardyn formulasyn bіladі. "Sender ekeulerin de durys tappadyndar" - vanaisa ushіnshіsi.
1. Sіzderdin oylaryңyzsha, osy үsh adamnyn kaysysy durys oilady (zhauaptaryңdy deleleldender)?
2. Yeger құtynyn (butylkanyң) ishіndegі zattyң kolemi 0,7 dm3 - he ten bolatyn belgili bolsa, zat molsherin zhane molekulaarne sanyn tabynyzdar.
3. Kutynyn ishindegi gazdyn molyarlyk massasyn eseptenіzder.
Sheshui.
1. Ushіnshi adam durys aitty, sebebі onynіshіnde aua bar (ol bos emes, endeshe birinshi adam durys tappady), al aua zheke zat emes (sol sebeptі ekіnshi adam da durys tappady). Aua birneshe gazdardyn kospasynan turady: N 2, O 2, Ar, CO 2, H 2 O jne.
2. Yagni zhagday kalypty, endesheV M = 22,4 l/mol. Zat molsherin esepteymizn = V / V M \u003d 0,7 / 22,4 l / mol \u003d 0,03125 mol. sana molekulN = N A n = 6,02 1023 mol-1 0,03125 mol = 1,88 1022 mol.
3. Auanyn kuramyn bile otyryp auanyn molyarlyk massasyn esepteuge bolady. Aua shamamen tomendegi gazdar cospasynan turady: 78% N2, 21% O2, 0,5% Ar ja 0,5% CO2 . Ortasha molyarlyk massas kümme boladaM vrd = xüks · M 1 + x 2 · M 2 + x 3 · M 3 + x 4 · M 4 = 0,78 28 + 0,21 32 + 0,05 40 + 0,05 44 ≈ 29 g/mol.
3. ülesanne.
Teie käsutuses on kaltsiumkarbonaat ja vesinikkloriidhape. Soovitage vähemalt 6 uue aine sünteesimeetodeid, sealhulgas 2 lihtsat. Sünteesides saab kasutada ainult lähteaineid, nende vastasmõju saadusi, vajalikke katalüsaatoreid ja elektrivoolu.
Lahendus.
1. CaCO 3 \u003d CaO + CO 2 (kuumutamisel)
2.
3.
4. CaO + H2O = Ca(OH)2
5. CaCl 2 \u003d Ca + Cl 2 (sulatuselektrolüüs)
6. 2 HCl \u003d H 2 + Cl 2 (lahuse elektrolüüs)
7. 2H2O = 2H2 + O2 (elektrolüüs)
8. Ca + H2 = CaH2
9. Ca(OH)2 + Cl2 = CaOCl2 + H2O (temperatuuril 0 °C)
10. kuumutamisel)
11. Cl2 + H2O = HCl + HClO (temperatuuril 0 °C)
12. 3 Cl 2 + 3 H 2 O \u003d 5 HCl + HClO 3 (kuumutamisel)
Esep3.
Sizderde kaltsium karbonaat y zhane tuz kyshkyly baar. Herilased zattar arkyly 6-dan kelle poolt emes zhana zattardy, onyn ishinde 2 zhai zattardy kalay aluga bolady? Süntees tek kana bastapky zattardy, olardan alyngan onnіmderdi koldanuga bolady, katalüsaator zhane electr togy kazhet.
Sheshui.
1. CaCO 3 \u003d CaO + CO 2 (kyzdyrganda)
2. CaCO3 + HCl = CaCl2 + CO2 + H2O
3. CaCO3 + CO2 + H2O = Ca(HCO3)2
4. CaO + H2O = Ca(OH)2
5. CaCl 2 \u003d Ca + Cl 2 (balküma elektrolüüs i)
6. 2 HCl \u003d H 2 + Cl 2 (erіtndі elektrolüüs i)
7. 2 H 2 O \u003d 2 H 2 + O 2 (elektrolüüs)
8. Ca + H2 \u003d CaH 2
9. Ca(OH)2 + Cl2 = CaOCl2 + H2O (0ºC-de)
10. 6Ca(OH)2 + 6Cl2 = 5CaCl2 + Ca(ClO3)2 + 6H2O ( kyzdygan kezde)
11. Cl2 + H2O = HCl + HClO (0ºC -de)
12. 3Cl2 + 3H2O = 5HCl + HClO3 (kyzdyrgan kezde)
4. ülesanne.
Kaht vesinikhalogeniidi sisaldava gaasisegu vesiniku tihedus on 38. Selle segu ruumala n juures. y. imendus võrdses koguses vett. 100 ml saadud lahuse neutraliseerimiseks kasutati 11,2 ml 0,4 mol/l naatriumhüdroksiidi lahust.
1. Tehke kindlaks, milliseid vesinikhalogeniide võiks see segu sisaldada.
2. Arvutage gaasisegu koostis mahuprotsentides.
3. Paku välja meetod gaasisegu kvalitatiivse koostise määramiseks.
Lahendus.
1. 1 mol gaasisegu mass n juures. y. on 38 2 \u003d 76 g. Seega ei saa gaasisegus samaaegselt esineda HBr ja HI ( M(HBr) \u003d 81 g / mol, M(TERE ) = 128 g/mol). Samuti ei saa nad samal ajal kohal olla. HF ja HCl ( M(HF) = 20 g/mol, M(HCl ) = 36,5 g/mol). Segu peab sisaldama vesinikhalogeniidi koosMalla 76 g/mol ja vesinikhalogeniidigaMrohkem kui 76 g/mol. Võimalikud segu koostised: 1) HF ja HBr; 2) HF ja HI; 3) HCl ja HBr; 4) HCl ja HI.
Vesinikhalogeniidide kontsentratsioon lahuses on (11,2 0,4): 100 = 0,0448 mol/l. See väärtus vastab üsna hästi arvutatud väärtusele 1:22,4 = 0,0446 mol/l 1 liitri gaasi (n.a.) lahustamisel 1 liitris vees (eeldusel, et vesinikhalogeniidi molekulid on monomeersed). Seega ei sisalda gaasisegu vesinikfluoriidi, mis on samuti gaasifaasis kujul ( HF ) n , kus n = 2-6.
Siis vastavad probleemi tingimustele ainult kaks segu varianti: HCl + HBr või HCl + HI.
2. HCl + HBr segu puhul: olgu x mool - kogus HCl 22,4 liitris segus (n.a.). Siis summa HBr on (1-x ) mol. 22,4 liitri segu mass on:
36,5x + 81 (1-x) = 76; x = 0,112; 1-x = 0,888.
Segu koostis: HCl - 11,2%, HBr - 88,8%.
Samamoodi segu jaoks HCl+HI:
36,5x + 128 (1-x) = 76; x = 0,562.
Segu koostis: HCl - 56,2%, HI - 43,8%
3. Kuna mõlemad segud peavad sisaldama vesinikkloriidi, jääb üle vesinikbromiidi või vesinikjodiidi kvalitatiivne määramine. Seda määratlust on mugavam teha lihtsate ainete - broomi või joodi - kujul. Vesinikhalogeniidide muundamiseks lihtsateks aineteks võib vesilahust oksüdeerida klooriga:
2HBr + Cl2 = 2HCl + Br2
2HI + Cl2 = 2HCl + I2
Saadud halogeenlahuseid saab eristada lahuse värvuse järgi mittepolaarses lahustis (ekstraheerimise ajal) või tundlikuma tärklise värvusreaktsiooni järgi.
Samuti saab algseid vesinikhalogeniide eristada hõbehalogeniidide erineva värvuse järgi:
HBr + AgNO 3 = AgBr ↓ + HNO 3 (helekollane sade)
HI + AgNO 3 = AgI ↓ + HNO 3 (kollane sade)
Esep 4.
Eki halogensutekten turatyn gaasi kospasynyn sutek boyinsha tygyzdygy 38. Herilased kospanyn қ.zh. Alyngan 100 ml eritindiin beitaraptaganda 11,2 ml 0,4 mol/l naatriumhüdroksüdiniin eritindisi teilealda.
1. Osy kospada kandai halogensutek baryn anyktanyzdar.
2. Gaas kospasynyn құramyn kolemdіk protsentipen anyқtaңyzdar.
3. Gaz kospasynyn sapasyn anyktaytyn zhagdaydy usynynyzdar.
Sheshui.
1. 1 mol gaasi kospasynyn massasy қ.zh. kuraydy: 38 2 \u003d 76 g. M(HBr) = 81 g/mol, M(HI) = 128 g/mol) bola almaida. Sonymen katar bіr mezgіlde HF jane HCl ( M(HF) = 20 g/mol, M(HCl) = 36,5 g/mol) bola almaida. Kosapada M massasy 76g/moldan az halogensutek bolusy kerek. Mүmkin bolatyn gas cospalary: 1) HF ja HBr; 2) HI asemel HF; 3) HCl HBr asemel; 4) HI asemel HCl.
Eritindidegi halosutekterdiini kontsentratsioonid (11,2 0,4): 100 = 0,0448 mol/l. Bulman 1 liiter suғa (halogensutec molekulid monomeerid bulgan zhagdaida) 1 liiter gaasi (қ.zh.) erіtu protsess үshіn tөmendegi esepteu nәtizhesіne zhақyn: 1:22.4 = 60.l044 = 60.l0. Endeshe, gas cospasynda fluorosutek bolmaida, sebi ol gas fazasynda (HF)n turinde boladas, mundagy n = 2-6.
Endeshe eseptin sharty tek ekі nuskaga seykes keledi: HCl + HBr nemese HCl + HI.
2. HCl + HBr kospasy ushіn: 22,4 l kospadagy (қ.zh.) HCl väike - x. Onda HBr noorem (1-x) bolada mutt. 22,4 l kospanyn massy:
36,5x + 81 (1-x) = 76; x = 0,112; 1-x = 0,888.
Kospa kuramy: HCl - 11,2%, HBr - 88,8%.
Kospa Ushin HCl+HI:
36,5x + 128 (1-x) = 76; x = 0,562.
Kospa kuramy: HCl - 56,2%, HI - 43,8%
3. Endeshe bromsutek zhane iodsutek ekі kospa da boluy tundub. Bul anyktama zhai zat turinde – broom nemese iod anyktauga yngayly. Halogensutekti zhai zatka ainaldyru ushіn onyn erіtіndіsіn chlormen totyқtyru kazhet:
2HBr + Cl2 = 2HCl + Br2
2HI + Cl2 = 2HCl + I2
Halogenderdin alyngan erіtіndіlerіn mittepolaarne erіtkіshtegі erіtіndinіnіn tүsі boyinsha ( kezіndegi ekstraheerimine) nemese starchdyn аserі аrkyly anyқboltaudy.
Sondai-aқ halosutekterdi kүmіs halogenidіndegi әrtүrlі tusterі arkyly anқtauғa boladas:
HBr + AgNO3 = AgBr↓ + HNO3 (ashyk-sary tunba)
HI + AgNO3 = AgI↓ + HNO3 (sary tunba)
Ülesanne 5 (Termokeemilised arvutused, lisandid).
1,5 g tsingiproovi põletamisel eraldus 5,9 kJ soojust. Tehke kindlaks, kas tsingiproov sisaldas mittesüttivaid lisandeid, kui on teada, et 1 mooli tsingi põletamisel eraldub 348 kJ soojust.
Esep5 ( Kospalar, tyermochemiyalyk esepteuler). 1,5 g myrysh үlgisіn zhakanda 5,9 kJ zhylu bolіndі. 1 mool myryshty zhakanda 348 kJ zhylu bөlіnetinіn bіle otyryp myrysh үlgisіnde zhanbaityn қospalar barma, zhқpa anyқtaңyzdar.
Lahendus:
Sheshui:
KEEMIA
Väljund
1. harjutus.
Dešifreerige transformatsiooniahel ja viige läbi keemilised reaktsioonid:
 |
positsioon: absoluutne; z-indeks:2;veeris-vasak:218px;veeris-ülemine:91px;laius:16px;kõrgus:55px">
 |
Lisaks teada:
Aine A- korund
AineB- kõige levinum metall (Mina) maapõues
Aine C- ühend, mis sisaldab 15,79% Me, 28,07% S, 56,14% O
Aine E- valge želatiinne aine, vees halvasti lahustuv. Aine C ja leelise vastasmõju saadus
AineD- kõige tavalisema metalli naatriumsool, mille molekul sisaldab 40 elektroni.
Lahendus:
A - Al 2 O 3
B-Al
C - Al2(SO4)3
D - NaAlO2
E – Al(OH)3
Aine iga konkreetse valemi eest - 1 punkt
Iga õigesti kirjutatud keemilise reaktsiooni võrrandi eest (koos teostustingimustega) - 2 punkti
KOKKU: 5 1+8 2 = 21 punkti
1 tapsirma.
Ainulaarne tizbegin ashyp, tendeuleriini keemiline reaktsioon:
 |
positsioon: absoluutne; z-indeks:15;veeris-vasak:218px;veeris-ülemine:91px;width:16px;height:55px">
 |
Kosymsha Belgili bulgaarlased:
AGAhull- korund
Bhull– zher sharynda en köp taralgan metal (mina)
FROM zaty - 15,79% mina, 28,07% S, 56,14% O turatyn kosylys
E hull - ak koimalzhyn zat, kohtud meie eridi. Zattyn siltimen әrekettesuinіnіn өnіmi С
D– en köp taralgan metaldyn naatriumi ässad, molekulid 40 electronnan turada.
Sheshui:
A - Al2O3
B-Al
C - Al2(SO4)3
D - NaAlO2
E – Al(OH)3
Әrbіr zattyn formulasyn anyktaғanga – 1 ұpaydan
Durys zhazylgan әrbіr chemiyalyk reaktsioon tendeuine (sharty korsetilgen) – 2 ұpaydan
BARLYGY: 5 1 + 8 2 \u003d 21 upay
2. ülesanne.Kuus numbriga keeduklaasi (keeduklaasi) sisaldavad tahkeid aineid (pulbrite kujul): naatriumvesinikkarbonaat, naatriumkloriid, tsinksulfaat, kaaliumfosfaat, kaltsiumkarbonaat, raudsulfaat ( II ). Määrake iga viaali (keeduklaasi) sisu, kasutades tabelil olevaid reaktiive ja seadmeid. Esitage iga aine keemiline valem ja kirjutage läbiviidud keemiliste reaktsioonide võrrandid.
Reaktiivid: 2 M HCl, 2 M NaOH, H2O destilleeritud, 2M lahus AgNO3
Varustus:rest katseklaasidega (7-10 tk), spaatliga, pipetid.
Lahendus:
Töö etapid | Tähelepanekud | Reaktsioonivõrrandid, järeldused |
|
Lahustage ainete proovid vees | Üks aine ei lahustunud | See on CaCO3 |
|
Lisage proovidele lahustunud ja lahustumata ained HCl | Gaas vabastatakse kahes katseklaasis. | NaHC03 + HCl = CaCO3 + HCl = |
|
Lisage prooviainetele naatriumhüdroksiidi lahust (mitte üleliigne) | Kahes katseklaasis on sademed rohelised (sood) ja valged amorfsed. | Need on FeSO4 ja Zn(NO3)2 FeSO4 + NaOH = Zn(NO3)2 + NaOH= |
|
Lisage proovidele tilkhaaval hõbenitraati | Kahes katseklaasis langevad välja valge kalgendatud ja kollane sade. | Need on NaCl ja K3PO4 NaCl + AgNO3 = K3PO4 + AgNO3= |
Iga aine määratluse eest 1 punkt.
Reaktsioonivõrrandi eest - 2 punkti
Kokku: 6 1+6 2 = 18 punkti
Märkus: kui kõik koefitsiendid ei ole reaktsioonivõrrandis paigutatud, kuid keemilise reaktsiooni olemus kajastub - 1 punkt
2 tapsirmi.Alty nomerlengen byukste (keemiline klaas) katty zat bar (ұntak turinde): naatriumvesinikkarbonaadid, naatriumkloriid, myryshg sulfaadid, kaaliumfosfaadid, kaltsiumkarbonaadid, temiir (II) sulfaadid. Stoldagy reaktivterdi zhane kuraldardy paydalana otyryp, arbir byukstegi zatty anyқtaңyzdar. Әrbіr zattyn chemiyalyk formulasyn zhane himiyalyk reaktsioon tendeulerin zhazynyzdar.
Reaktiiv:2M HCl, 2M NaOH, destildengen H2O, 2M AgNO3 eritindis
Құral-zhabdyқtar: probirkalaarne riba statiiv (7-10 dan), spaatel (ұstagysh), pipett alar.
Sheshui:
Zhymys etaptary | Kubylys | Tendeuleri reaktsioon |
|
Zattyn eritu õukonna müürseppade poeg | Bir zat ta erigen zhok | Bull CaCO3 |
|
Yerigen zhane erimegen zattyn masyn NSI kosu poeg | Eki katseklaasi gaas bөlinedі | NaHC03 + HCl = CaCO3 + HCl = |
|
Ema poja poja Zattyn naatriumhüdroksüdiini kosu (az molsherde) | Ekі prrobirkada zhasyl tusti (saz balshyқ tәrіzdі) zhane ak tusti amorty tunba payda bolada | Bull FeSO4 ja Zn(NO3)2 FeSO4 + NaOH = Zn(NO3)2 + NaOH= |
|
Synamaga tamshylatyp kүmis nitratyn қosamyz | Ekі katseklaas ақ іrіmshіk terіzdі zhane sary tұnba tүsedі. | Bul NaCl zhane K3PO4 NaCl + AgNO3 = K3PO4 + AgNO3= |
Arbir zatty anyktaganga 1 ұpaydan.
Arbir tendeuine reaktsioon - 2 ұpaydan.
Barlygy: 6 1+6 2 = 18Upay
Eskertu: Yeger tendeuinde barlyk reaktsioonikoefitsient koyylmagan bolsa, biraq chemiyialik reaktsioon mani anyқtalgan bolsa – 1 ұpay beruge bolada
PRAKTILINE TÖÖ (1 h) 8. klass
Tööd teostavad õpilased iseseisvalt õpetaja juhendamisel.
Pakun välja oma aastatepikkuse töö tulemuse üldkoolis praktiliste tööde ettevalmistamisel ja läbiviimisel 8.–9. klassi keemiatundides:
- Hapniku saamine ja omadused,
- "Soolalahuste valmistamine lahustunud aine teatud massiosaga",
- "Teabe üldistamine kõige olulisemate anorgaaniliste ühendite klasside kohta",
- "Elektrolüütiline dissotsiatsioon",
- "Hapniku alarühm" (vt ajalehe "Keemia" järgmist numbrit).
Neid kõiki katsetan mina klassiruumis. Neid saab kasutada keemia koolikursuse õppimisel nii O.S. Gabrielyani uue programmi kui ka G.E. Rudzitise, F.G. Feldmani programmi järgi.
Õpilaskatse on iseseisva töö liik. Eksperiment mitte ainult ei rikasta õpilasi uute mõistete, oskuste, oskustega, vaid on ka viis omandatud teadmiste tõesuse kontrollimiseks, aitab kaasa materjali sügavamale mõistmisele, teadmiste omastamisele. See võimaldab teil ümbritseva maailma tajumise muutlikkuse põhimõtet täielikumalt rakendada, kuna selle põhimõtte põhiolemus on seos eluga, õpilaste tulevase praktilise tegevusega.
Eesmärgid. Oskama laboris hapnikku vastu võtta ja koguda kahel meetodil: õhuväljasurve ja veeväljasurve; kinnitada katseliselt hapniku omadusi; teadke ohutusreegleid.
Varustus. Jalaga metallist alus, piirituslamp, tikud, õhutustoruga katseklaas, katseklaas, vatipall, pipett, keeduklaas, kild, lahutusnõel (või traat), kristallisaator veega, kaks korgiga koonilisse kolbi.
Reaktiivid. KMnO 4 kristalne (5–6 g), Ca (OH) 2 lubjavesi, puusüsi,
Fe (terastraat või kirjaklamber).
Ohutusreeglid.
Käsitsege keemilisi seadmeid ettevaatlikult!
Pea meeles! Katseklaasi kuumutatakse, hoides seda kaldasendis kogu pikkuses kahe või kolme liigutusega alkohollambi leegis. Kuumutamisel suuna katseklaasi ava endast ja naabritest eemale.
Varem saavad õpilased eelseisva töö sisu uurimisega seotud kodutööd vastavalt juhendile, kasutades samaaegselt O.S.Gabrieliani (§ 14, 40) või G.E. Rudzitise, F.G.Feldmani 8. klassi õpikute materjale (§ 19 kakskümmend). Praktiliste tööde vihikutesse kirjutatakse üles teema nimetus, eesmärk, loetletakse seadmed ja reaktiivid, koostatakse ettekande tabel.
TUNNIDE AJAL
Ühe kogemuse panin kõrgemale
kui tuhat arvamust
ainult sündinud
kujutlusvõime.
M.V. Lomonosov
Hapniku saamine
õhu väljatõrjumise meetod
(10 min)
1. Kaaliumpermanganaat (KMnO 4) asetage kuiva katseklaasi. Asetage katseklaasi avasse lahtine vatipall.
2. Sulgege katseklaas gaasi väljalasketoruga korgiga, kontrollige tihedust (joonis 1).
|
Riis. üks.
|
(Õpetaja selgitused seadme lekete kontrollimiseks.) Kinnitage seade statiivi jalga.
3. Langetage gaasi väljalasketoru 2–3 mm kaugusel põhja puudutamata klaasi sisse (joonis 2).
4. Soojendage aine katseklaasis. (Pidage meeles ohutusnõudeid.)
5. Kontrollige gaasi olemasolu hõõguva killu (süsi) abil. Mida sa vaatad? Miks saab hapnikku koguda õhu väljatõrjumise teel?
6. Koguge saadud hapnik kahte kolbi järgmiste katsete jaoks. Sulgege kolvid korkidega.
7. Koostage tabeli abil aruanne. 1, mille asetate oma märkmiku levialale.
Hapniku saamine
veeväljasurve meetod
(10 min)
1. Täitke katseklaas veega. Sulgege toru pöidlaga ja keerake see tagurpidi. Selles asendis langetage käsi koos katseklaasiga veega kristallisaatorisse. Tooge katseklaas gaasi väljalasketoru otsa, ilma seda veest eemaldamata (joonis 3).
2. Kui hapnik on vee torust välja surunud, sulgege see pöidlaga ja eemaldage see veest. Miks saab hapnikku koguda vee väljatõrjumisega?
Tähelepanu! Eemaldage gaasi väljalasketoru kristallisaatorist, jätkates toru kuumutamist KMnO 4 -ga. Kui seda ei tehta, visatakse vesi kuuma katseklaasi. Miks?
Söe põletamine hapnikus
(5 minutit)
1. Kinnitage kivisüsi metalltraadile (lahkamisnõel) ja viige see alkohollambi leeki.
2. Laske tulikuum kivisüsi hapnikuga kolbi. Mida sa vaatad? Andke selgitus (joonis 4).
3. Pärast põlemata söe kolvist väljavõtmist valage sinna 5-6 tilka lubjavett
Ca(OH)2. Mida sa vaatad? Andke selgitus.
4. Tabelis tehtud töö kohta väljastada aruanne. üks.
Põlev teras (raud) traat
hapnikus
(5 minutit)
1. Kinnitage tikutükk terastraadi ühte otsa. Süüta tikk. Kastke traat koos põleva tikuga hapnikuga kolbi. Mida sa vaatad? Andke selgitus (joonis 5).
2. Tabelis tehtud töö kohta väljastada aruanne. üks.
Tabel 1
| Toimingud pooleli (mida nad tegid) |
Joonised algsete ja saadud ainete tähistustega | Tähelepanekud. Tingimused reaktsioonide läbiviimine. Reaktsioonivõrrandid |
Vaatluste selgitused. järeldused |
|---|---|---|---|
| Seadme kokkupanek hapniku saamiseks. Seadme lekete kontrollimine | |||
| Hapniku saamine kuumutamisel KMnO 4-st |
|||
| Hapniku tootmise tõend koos hõõguv kild |
|||
| O 2 füüsikaliste omaduste tunnused. O2 kogumine kahel viisil: õhu väljatõrjumine, veeväljasurve |
|||
| Iseloomulik O2 keemilised omadused. Interaktsioon lihtsate ainetega põlev kivisüsi, põlev raud (terastraat, kirjaklamber) |
Tee kirjalik üldjäreldus tehtud töö kohta (5 min).
VÄLJUND. Üheks võimaluseks laboris hapniku saamiseks on KMnO 4 lagundamine. Hapnik on värvitu ja lõhnatu gaas, õhust 1,103 korda raskem ( Härra(O 2) \u003d 32, Härra(õhk) \u003d 29, millest järgneb 32/29 1,103), vees kergelt lahustuv. See reageerib lihtsate ainetega, moodustades oksiide.
Seadke töökoht korda (3 min): võtke seade lahti, asetage nõud ja tarvikud oma kohale.
Esitage oma märkmikud ülevaatamiseks.
Kodutöö.
Ülesanne. Tehke kindlaks, milline rauaühenditest - Fe 2 O 3 või Fe 3 O 4 - on rauarikkam?
| Antud: | Leidma: |
| Fe2O3, Fe304. |
(Fe) Fe2O3-s, "(Fe) kuni Fe 3 O 4 |
Lahendus
(X) = n A r(X)/ Härra, kus n- elemendi X aatomite arv aine valemis.
Härra(Fe 2 O 3) \u003d 56 2 + 16 3 \u003d 160,
(Fe) \u003d 56 2/160 \u003d 0,7,
(Fe) = 70%
Härra(Fe 3 O 4) \u003d 56 3 + 16 4 \u003d 232,
"(Fe) \u003d 56 3/232 \u003d 0,724,
"(Fe) = 72,4%.
Vastus. Fe 3 O 4 on rauarikkam kui Fe 2 O 3 .
Praktilise töö käigus jälgib õpetaja õpilaste võtete ja toimingute sooritamise õigsust ning märgib oskuste arvestuskaardile (tabel 2).
tabel 2
Oskuste arvestuskaart
| Praktilise töö operatsioonid | Õpilaste perekonnanimed | |||||
|---|---|---|---|---|---|---|
| AGA | B | IN | G | D | E | |
| Seadme kokkupanek hapniku saamiseks | ||||||
| Seadme lekete kontrollimine | ||||||
| Katseklaasi kinnitamine statiivi jalga | ||||||
| Alkohollampide käsitsemine | ||||||
| Katseklaasi kuumutamine KMnO 4-ga | ||||||
| O2 vabanemise kontrollimine | ||||||
| O 2 kogumine anumasse kahel viisil: õhu väljatõrjumine, veeväljasurve |
||||||
| kivisöe põletamine | ||||||
| Fe (terastraadi) põletamine | ||||||
| Eksperimentaalne kultuur | ||||||
| Töö tegemine märkmikusse | ||||||
Näidisaruanne tehtud praktilisest tööst (tabel 1)
hõõguv kild
(süsi) süttib eredalt
O 2-s
O2 füüsikalised omadused. O2 kogumine kahel viisil:
õhuväljasurve (a),
veeväljasurve (b)

õhust veidi raskem, seega
see kogutakse põhja asetatud anumasse. Hapnik lahustub vees vähe


Lubjavesi muutub häguseks, kuna moodustub vees lahustumatu CaCO 3 sade:
CO 2 + Ca (OH) 2 CaCO 3 + H 2 O. Raud põleb hapnikus ereda leegiga:

lihtsaga
ained - metallid ja mittemetallid. Valge sademe moodustumine kinnitab CO 2 olemasolu kolvis