Eksperymentalne uzasadnienie podstawowych zasad kinetyki molekularnej. Podstawowe przepisy ICT i ich eksperymentalne uzasadnienie
12. Podstawowe zasady teorii kinetyki molekularnej i ich uzasadnienie doświadczalne. Masa i wielkość cząsteczek
Teoria wyjaśniająca budowę i właściwości ciał na podstawie praw ruchu i interakcji cząstek tworzących ciała nazywa się kinetyka molekularna.
Podstawowe zasady teorii kinetyki molekularnej (MKT) są sformułowane w następujący sposób:
Każda substancja ma dyskretną (nieciągłą) strukturę. Składa się z pojedynczych cząstek (cząsteczek, atomów, jonów) oddzielonych spacjami.
Cząstki znajdują się w stanie ciągłego chaotycznego ruchu zwanego ruchem termicznym.
Cząsteczki oddziałują ze sobą. W procesie ich interakcji powstają siły przyciągania i odpychania.
Ważność ICT potwierdzają liczne obserwacje i fakty.
Obecność przepuszczalności, ściśliwości i rozpuszczalności w substancjach wskazuje, że nie są one ciągłe, ale składają się z pojedynczych cząstek oddzielonych spacjami. Wykorzystując nowoczesne metody badawcze (mikroskopy elektronowe i jonowe) uzyskano obrazy największych cząsteczek.
Ruchy Browna i dyfuzja wskazują, że cząstki znajdują się w ciągłym ruchu.
Obecność wytrzymałości i sprężystości ciał, zjawisko zwilżania, napięcie powierzchniowe w cieczach itp. udowodnić istnienie sił oddziaływania pomiędzy cząsteczkami.
Masa i wielkość cząsteczek.
Rozmiar cząsteczek jest wartością względną. Ocenia się to następująco. Pomiędzy cząsteczkami, wraz z siłami przyciągającymi, działają również siły odpychające, więc cząsteczki mogą zbliżać się do siebie tylko na pewną odległość. Odległość maksymalnego zbliżenia między środkami cząsteczek nazywa się efektywna średnica cząsteczki.(W tym przypadku tradycyjnie zakłada się, że cząsteczki mają kształt kulisty.)
Stosując liczne metody określania mas i rozmiarów cząsteczek ustalono, że z wyjątkiem cząsteczek substancji organicznych zawierających bardzo dużą liczbę atomów, większość cząsteczek w rzędzie wielkości ma średnicę 1,10 - 10 m i masie 1,10 - 26 kg.
Względna masa cząsteczkowa.
Względna masa cząsteczkowa (lub atomowa). Pan (Lub A r ) nazywają wartość równą stosunkowi masy cząsteczki (lub atomu) m o tej substancji do 1/12 masy atomu węgla m o C, tj.
Względna masa cząsteczkowa (atomowa) jest wielkością bezwymiarową.
Ilość substancji. Masa cząsteczkowa. Masa cząsteczki.
Ilość substancji ν to wartość równa stosunkowi liczby cząsteczek (lub atomów) N w danym ciele do liczby atomów N A w 0,012 kg węgla, tj. ν = N/ N A (N A to liczba Avogadro).
Masa molowa M substancji to masa 1 mola tej substancji.
W związku z tym masę cząsteczki (atomu) można wyznaczyć z zależności
13. Gaz doskonały. Podstawowe równanie μmt gazu doskonałego
Gaz doskonały to taki gaz, przy opisie którego właściwości przyjmuje się następujące założenia: nie uwzględniają one wewnętrznej wielkości cząsteczek gazu i nie uwzględniają sił oddziaływania między nimi.
Zatem model gazu doskonałego to zbiór chaotycznie poruszających się punktów materialnych, które oddziałują ze sobą oraz ze ściankami pojemnika zawierającego gaz jedynie w bezpośrednim zderzeniu.
Definicja 1
Teoria kinetyki molekularnej to doktryna o budowie i właściwościach materii, opierająca się na idei istnienia atomów i cząsteczek, jako najmniejszych cząstek substancji chemicznych.
Podstawowe zasady molekularnej teorii kinetyki cząsteczki:
- Wszystkie substancje mogą występować w stanie ciekłym, stałym i gazowym. Tworzą się z cząstek zbudowanych z atomów. Cząsteczki elementarne mogą mieć złożoną strukturę, to znaczy mogą zawierać kilka atomów. Cząsteczki i atomy to cząstki obojętne elektrycznie, które w pewnych warunkach uzyskują dodatkowy ładunek elektryczny i stają się jonami dodatnimi lub ujemnymi.
- Atomy i cząsteczki poruszają się w sposób ciągły.
- Cząstki o elektrycznym charakterze siły oddziałują ze sobą.
Główne przepisy ICT i ich przykłady zostały wymienione powyżej. Pomiędzy cząsteczkami oddziaływanie grawitacyjne jest niewielkie.
Rysunek 3. 1. 1. Trajektoria cząstki Browna.
Definicja 2
Ruch Browna cząsteczek i atomów potwierdza istnienie podstawowych zasad teorii kinetyki molekularnej i potwierdza je eksperymentalnie. Ten termiczny ruch cząstek zachodzi w przypadku cząsteczek zawieszonych w cieczy lub gazie.
Eksperymentalne uzasadnienie głównych założeń teorii kinetyki molekularnej
W 1827 r. R. Brown odkrył ten ruch, który był spowodowany przypadkowymi uderzeniami i ruchami cząsteczek. Ponieważ proces przebiegał chaotycznie, ciosy nie mogły się wzajemnie zrównoważyć. Stąd wniosek, że prędkość cząstki Browna nie może być stała, ulega ciągłym zmianom, a ruch kierunkowy przedstawiono w postaci zygzaka, jak pokazano na rysunku 3. 1. 1.
A. Einstein mówił o ruchach Browna w 1905 roku. Jego teoria została potwierdzona w doświadczeniach J. Perrina w latach 1908 - 1911.
Definicja 3
Konsekwencja teorii Einsteina: przesunięcie kwadratowe< r 2 >Cząstka Browna w stosunku do położenia początkowego, uśredniona dla wielu cząstek Browna, jest proporcjonalna do czasu obserwacji t.
Wyrażenie< r 2 >= D t wyjaśnia prawo dyfuzji. Zgodnie z teorią mamy, że D wzrasta monotonicznie wraz ze wzrostem temperatury. Przypadkowy ruch jest widoczny w obecności dyfuzji.
Definicja 4
Dyfuzja- tak definiuje się zjawisko wnikania w siebie dwóch lub więcej stykających się substancji.
Proces ten zachodzi szybko w gazie heterogenicznym. Dzięki przykładom dyfuzji o różnych gęstościach można uzyskać jednorodną mieszaninę. Kiedy tlen O2 i wodór H2 znajdą się w tym samym naczyniu z przegrodą, po jej usunięciu gazy zaczynają się mieszać, tworząc niebezpieczną mieszaninę. Proces ten jest możliwy, gdy wodór znajduje się na górze, a tlen na dole.
Procesy wzajemnego przenikania zachodzą także w cieczach, jednak znacznie wolniej. Jeśli rozpuścimy substancję stałą, cukier, w wodzie, otrzymamy jednorodny roztwór, co jest wyraźnym przykładem procesów dyfuzji w cieczach. W rzeczywistych warunkach mieszanie cieczy i gazów jest maskowane przez szybkie procesy mieszania, na przykład podczas występowania prądów konwekcyjnych.
Dyfuzja ciał stałych charakteryzuje się małą szybkością. Jeżeli oczyścimy powierzchnię oddziaływania metali, to widać, że po dłuższym czasie w każdym z nich pojawią się atomy innego metalu.
Definicja 5
Dyfuzja i ruchy Browna są uważane za zjawiska powiązane.
Kiedy cząstki obu substancji przenikają się, ruch jest przypadkowy, to znaczy obserwuje się chaotyczny ruch termiczny cząsteczek.
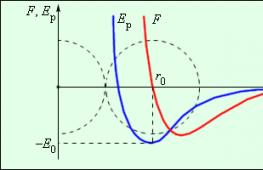
Siły działające pomiędzy dwiema cząsteczkami zależą od odległości między nimi. Cząsteczki zawierają ładunki dodatnie i ujemne. Na dużych odległościach dominują siły przyciągania międzycząsteczkowego, na małych – siły odpychania.
Rysunek 3 . 1 . 2 pokazuje zależność powstałej siły F i energii potencjalnej E p oddziaływania między cząsteczkami od odległości między ich środkami. W odległości r = r 0 siła oddziaływania staje się zerowa. Odległość tę tradycyjnie przyjmuje się jako średnicę cząsteczki. Przy r = r 0 energia potencjalna interakcji jest minimalna.
Definicja 6
Aby odsunąć dwie cząsteczki na odległość r 0, należy przekazać E 0, tzw energia wiązania lub potencjalna głębokość odwiertu.

Rysunek 3. 1. 2.Siła interakcji F i potencjalna energia oddziaływania E r dwie cząsteczki. F > 0- siła odpychająca, F< 0 - siła grawitacji.
Ponieważ cząsteczki są małe, proste cząsteczki jednoatomowe mogą mieć nie więcej niż 10–10 m. Złożone mogą osiągać rozmiary setki razy większe.
Definicja 7
Nazywa się to przypadkowym, chaotycznym ruchem cząsteczek ruch termiczny.
Wraz ze wzrostem temperatury wzrasta energia kinetyczna ruchu termicznego. W niskich temperaturach średnia energia kinetyczna w większości przypadków okazuje się mniejsza niż głębokość studni potencjalnej E 0 . Ten przypadek pokazuje, że cząsteczki przepływają do cieczy lub ciała stałego w średniej odległości między nimi r 0 . Jeśli temperatura wzrośnie, wówczas średnia energia kinetyczna cząsteczki przekracza E 0, następnie rozpadają się i tworzą substancję gazową.
W ciałach stałych cząsteczki poruszają się losowo wokół ustalonych centrów, czyli położeń równowagi. Mogą być rozmieszczone w przestrzeni w sposób nieregularny (w ciałach amorficznych) lub z utworzeniem uporządkowanych struktur objętościowych (ciała krystaliczne).
Stany skupienia substancji
Swoboda termicznego ruchu cząsteczek jest widoczna w cieczach, ponieważ nie są one powiązane z ośrodkami, co umożliwia ruch w całej objętości. To wyjaśnia jego płynność.
Definicja 8
Jeśli cząsteczki są zlokalizowane blisko siebie, mogą tworzyć uporządkowane struktury z kilkoma cząsteczkami. Zjawisko to nazywa się zamówienie krótkiego zasięgu. Zamówienie dalekiego zasięgu charakterystyczne dla ciał krystalicznych.
Odległość pomiędzy cząsteczkami w gazach jest znacznie większa, zatem działające siły są małe, a ich ruchy przebiegają po linii prostej w oczekiwaniu na kolejne zderzenie. Wartość 10 – 8 m to średnia odległość pomiędzy cząsteczkami powietrza w normalnych warunkach. Ponieważ oddziaływanie sił jest słabe, gazy rozszerzają się i mogą wypełnić dowolną objętość naczynia. Kiedy ich interakcja zmierza do zera, mówią o gazie doskonałym.
Model kinetyczny gazu doskonałego
W μt ilość substancji uważa się za proporcjonalną do liczby cząstek.
Definicja 9
Kret- jest to ilość substancji zawierająca tyle cząstek (cząsteczek), ile jest atomów w 0,012 kg węgla C 12. Cząsteczka węgla składa się z jednego atomu. Wynika z tego, że 1 mol substancji ma taką samą liczbę cząsteczek. Ten numer się nazywa stały Awogadro N A: N A = 6,02 ċ 1023 mol – 1.
Wzór na określenie ilości substancji ν zapisuje się jako stosunek N liczby cząstek do stałej Avogadra N A: ν = N N A .
Definicja 10
Masa jednego mola substancji nazywa się masą molową M. Jest ona ustalona w postaci wzoru M = N A ċ m 0.
Masę molową wyraża się w kilogramach na mol (kg/mol).
Definicja 11
Jeśli substancja zawiera jeden atom, możemy mówić o masie atomowej cząstki. Jednostką atomu jest 1 12 mas izotopu węgla C 12, tzw jednostka masy atomowej i jest zapisane jako ( A. jeść.): 1a. e.m. = 1,66 ċ 10 – 27 kg.
Wartość ta pokrywa się z masą protonu i neutronu.
Definicja 12
Nazywa się stosunek masy atomu lub cząsteczki danej substancji do 1 12 masy atomu węgla masa względna.
Jeśli zauważysz błąd w tekście, zaznacz go i naciśnij Ctrl+Enter
Teoria kinetyki molekularnej to dziedzina fizyki badająca właściwości różnych stanów materii, bazująca na idei istnienia cząsteczek i atomów jako najmniejszych cząstek materii. ICT opiera się na trzech głównych zasadach:
1. Wszystkie substancje składają się z drobnych cząstek: cząsteczek, atomów lub jonów.
2. Cząstki te znajdują się w ciągłym, chaotycznym ruchu, którego prędkość określa temperaturę substancji.
3. Pomiędzy cząstkami występują siły przyciągania i odpychania, których charakter zależy od odległości między nimi.
Główne postanowienia ICT potwierdzają liczne fakty eksperymentalne. Istnienie cząsteczek, atomów i jonów zostało udowodnione eksperymentalnie, cząsteczki zostały dostatecznie zbadane, a nawet sfotografowane za pomocą mikroskopów elektronowych. Zdolność gazów do rozszerzania się w nieskończoność i zajmowania całej dostarczonej im objętości tłumaczy się ciągłym chaotycznym ruchem cząsteczek. Elastyczność gazów, ciał stałych i cieczy, zdolność cieczy do zwilżania niektórych ciał stałych, procesy barwienia, sklejania, zachowywania kształtu przez ciała stałe i wiele więcej wskazują na istnienie sił przyciągania i odpychania pomiędzy cząsteczkami. Zjawisko dyfuzji – zdolność cząsteczek jednej substancji do wnikania w przestrzenie pomiędzy cząsteczkami drugiej – również potwierdza główne założenia MCT. Zjawisko dyfuzji wyjaśnia na przykład rozprzestrzenianie się zapachów, mieszanie się różnych cieczy, proces rozpuszczania ciał stałych w cieczach oraz spawanie metali poprzez ich topienie lub pod ciśnieniem. Potwierdzeniem ciągłego chaotycznego ruchu cząsteczek jest także ruch Browna – ciągły chaotyczny ruch mikroskopijnych cząstek nierozpuszczalnych w cieczy.
Ruch cząstek Browna tłumaczy się chaotycznym ruchem cząstek cieczy, które zderzają się z cząstkami mikroskopijnymi i wprawiają je w ruch. Udowodniono eksperymentalnie, że prędkość cząstek Browna zależy od temperatury cieczy. Teorię ruchów Browna opracował A. Einstein. Prawa ruchu cząstek mają charakter statystyczny i probabilistyczny. Znany jest tylko jeden sposób na zmniejszenie intensywności ruchów Browna – obniżenie temperatury. Istnienie ruchu Browna w przekonujący sposób potwierdza ruch cząsteczek.
Każda substancja składa się z cząstek, dlatego przyjmuje się, że ilość substancji v jest proporcjonalna do liczby cząstek, czyli elementów strukturalnych zawartych w organizmie.
Jednostką ilości substancji jest mol. Mol to ilość substancji zawierająca taką samą liczbę elementów strukturalnych dowolnej substancji, ile jest atomów w 12 g węgla C12. Stosunek liczby cząsteczek substancji do ilości substancji nazywa się stałą Avogadra:
Stała Avogadra pokazuje, ile atomów i cząsteczek zawiera jeden mol substancji. Masa molowa to masa jednego mola substancji, równa stosunkowi masy substancji do ilości substancji:
Masę molową wyraża się w kg/mol. Znając masę molową, możesz obliczyć masę jednej cząsteczki:
Średnią masę cząsteczek wyznacza się zwykle metodami chemicznymi, natomiast stałą Avogadro wyznacza się z dużą dokładnością kilkoma metodami fizycznymi. Masy cząsteczek i atomów wyznacza się ze znaczną dokładnością za pomocą spektrografu masowego.
Masy cząsteczek są bardzo małe. Na przykład masa cząsteczki wody:
Masa molowa jest powiązana ze względną masą cząsteczkową Mg. Względna masa cząsteczkowa to wartość równa stosunkowi masy cząsteczki danej substancji do 1/12 masy atomu węgla C12. Jeżeli znany jest wzór chemiczny substancji, wówczas za pomocą układu okresowego można wyznaczyć jej masę względną, która wyrażona w kilogramach oznacza masę molową tej substancji.
Teoria kinetyki molekularnej to dziedzina fizyki badająca właściwości różnych stanów materii, bazująca na idei istnienia cząsteczek i atomów jako najmniejszych cząstek materii. ICT opiera się na trzech głównych zasadach:
1. Wszystkie substancje składają się z drobnych cząstek: cząsteczek, atomów lub jonów.
2. Cząstki te znajdują się w ciągłym, chaotycznym ruchu, którego prędkość określa temperaturę substancji.
3. Pomiędzy cząstkami występują siły przyciągania i odpychania, których charakter zależy od odległości między nimi.
Główne postanowienia ICT potwierdzają liczne fakty eksperymentalne. Istnienie cząsteczek, atomów i jonów zostało udowodnione eksperymentalnie, cząsteczki zostały dostatecznie zbadane, a nawet sfotografowane za pomocą mikroskopów elektronowych. Zdolność gazów do rozszerzania się i zajmowania w nieskończoność Wszystko zapewnioną przez nią objętość tłumaczy się ciągłym chaotycznym ruchem cząsteczek. Elastyczność gazy, ciała stałe i ciecze, zdolność cieczy
zwilżanie niektórych ciał stałych, procesy barwienia, sklejania, utrzymywania kształtu przez ciała stałe i wiele innych wskazują na istnienie sił przyciągania i odpychania pomiędzy cząsteczkami. Zjawisko dyfuzji – zdolność cząsteczek jednej substancji do wnikania w przestrzenie pomiędzy cząsteczkami drugiej – również potwierdza główne założenia MCT. Zjawisko dyfuzji wyjaśnia na przykład rozprzestrzenianie się zapachów, mieszanie się różnych cieczy, proces rozpuszczania ciał stałych w cieczach oraz spawanie metali poprzez ich topienie lub pod ciśnieniem. Potwierdzeniem ciągłego chaotycznego ruchu cząsteczek jest także ruch Browna – ciągły chaotyczny ruch mikroskopijnych cząstek nierozpuszczalnych w cieczy.
Ruch cząstek Browna tłumaczy się chaotycznym ruchem cząstek cieczy, które zderzają się z cząstkami mikroskopijnymi i wprawiają je w ruch. Udowodniono eksperymentalnie, że prędkość cząstek Browna zależy od temperatury cieczy. Teorię ruchów Browna opracował A. Einstein. Prawa ruchu cząstek mają charakter statystyczny i probabilistyczny. Znany jest tylko jeden sposób na zmniejszenie intensywności ruchów Browna – obniżenie temperatury. Istnienie ruchu Browna w przekonujący sposób potwierdza ruch cząsteczek.
Dlatego każda substancja składa się z cząstek ilość substancji uważa się za proporcjonalną do liczby cząstek, czyli elementów strukturalnych zawartych w organizmie, v.
Jednostką ilości substancji jest kret.Kret- jest to ilość substancji zawierająca taką samą liczbę elementów strukturalnych dowolnej substancji, ile jest atomów w 12 g węgla C 12. Nazywa się stosunkiem liczby cząsteczek substancji do ilości substancji Stała Avogadro:
nie= N/ w. na = 6,02 10 23 kret -1 .
Stała Avogadra pokazuje, ile atomów i cząsteczek zawiera jeden mol substancji. Masa cząsteczkowa jest wielkością równą stosunkowi masy substancji do ilości substancji:
M = m/ w.
Masę molową wyraża się w kg/mol. Znając masę molową, możesz obliczyć masę jednej cząsteczki:
m 0 = m/N = m/vN A= M/ NIE
Średnią masę cząsteczek wyznacza się zwykle metodami chemicznymi, natomiast stałą Avogadro wyznacza się z dużą dokładnością kilkoma metodami fizycznymi. Masy cząsteczek i atomów wyznacza się ze znaczną dokładnością za pomocą spektrografu masowego.
Masy cząsteczek są bardzo małe. Na przykład masa cząsteczki wody: t = 29,9 10 -27 kg.
Masa molowa jest powiązana ze względną masą cząsteczkową Mr. Względna masa molowa to wartość równa stosunkowi masy cząsteczki danej substancji do 1/12 masy atomu węgla C12. Jeżeli znany jest wzór chemiczny substancji, wówczas za pomocą układu okresowego można wyznaczyć jej masę względną, która wyrażona w kilogramach oznacza masę molową tej substancji.