Eksperimentalno potvrđivanje temeljnih principa molekularne kinetike. Osnovne odredbe IKT-a i njihovo eksperimentalno opravdanje
12. Temeljna načela molekularne kinetičke teorije i njihova eksperimentalna potkrijepljenost. Masa i veličina molekula
Teorija koja objašnjava građu i svojstva tijela na temelju zakona gibanja i međudjelovanja čestica koje čine tijela naziva se molekularna kinetika.
Osnovni principi molekularne kinetičke teorije (MKT) formulirani su na sljedeći način:
Svaka tvar ima diskretnu (diskontinuiranu) strukturu. Sastoji se od pojedinačnih čestica (molekula, atoma, iona) odvojenih razmacima.
Čestice su u stanju kontinuiranog kaotičnog gibanja koje se naziva toplinsko gibanje.
Čestice međusobno djeluju. U procesu njihove interakcije nastaju sile privlačenja i odbijanja.
Valjanost IKT-a potvrđuju brojna zapažanja i činjenice.
Prisutnost propusnosti, stlačivosti i topljivosti u tvarima ukazuje na to da one nisu kontinuirane, već se sastoje od pojedinačnih čestica odvojenih razmacima. Suvremenim metodama istraživanja (elektronski i ionski mikroskopi) dobivene su slike najvećih molekula.
Brownovo gibanje i difuzija pokazuju da su čestice u kontinuiranom gibanju.
Prisutnost čvrstoće i elastičnosti tijela, pojava vlaženja, površinski napon u tekućinama itd. dokazati postojanje sila međudjelovanja među molekulama.
Masa i veličina molekula.
Veličina molekula je relativna vrijednost. Ocjenjuje se kako slijedi. Između molekula, uz privlačne sile, djeluju i odbojne sile, pa se molekule mogu približiti jedna drugoj samo na određenu udaljenost. Udaljenost maksimalnog približavanja između središta molekula naziva se efektivni promjer molekule.(U ovom slučaju, konvencionalno se pretpostavlja da molekule imaju sferni oblik.)
Koristeći brojne metode za određivanje masa i veličina molekula, utvrđeno je da, s izuzetkom molekula organskih tvari koje sadrže vrlo velik broj atoma, većina molekula, prema redu veličine, ima promjer od 1·10 - 10 m i mase 1·10 - 26 kg.
Relativna molekularna težina.
Relativna molekularna (ili atomska) masa M r (ili A r ) nazivaju vrijednost koja je jednaka omjeru mase molekule (ili atoma) m o ove tvari prema 1/12 mase atoma ugljika m o C, t j .
Relativna molekulska (atomska) masa je bezdimenzijska veličina.
Količina tvari. Molekulska masa. Masa molekule.
Količina tvari ν je vrijednost jednaka omjeru broja molekula (ili atoma) N u određenom tijelu prema broju atoma N A u 0,012 kg ugljika, t j . ν = N/ N A (NA je Avogadrov broj).
Molarna masa M tvari je masa 1 mola te tvari.
Posljedično, masa molekule (atoma) može se odrediti iz relacije
13. Idealni plin. Osnovna jednadžba μmt idealnog plina
Idealan plin je takav plin, pri opisivanju svojstava koje se koriste sljedećim pretpostavkama: ne uzimaju u obzir vlastitu veličinu molekula plina i ne uzimaju u obzir sile međudjelovanja među njima.
Dakle, model idealnog plina je skup kaotično pokretnih materijalnih točaka koje djeluju jedna na drugu i na stijenke spremnika koji sadrži plin samo u izravnom sudaru.
Definicija 1
Molekularno kinetička teorija je doktrina o građi i svojstvima materije, koja se temelji na ideji postojanja atoma i molekula, kao najmanjih čestica kemijskih tvari.
Osnovni principi molekularne kinetičke teorije molekule:
- Sve tvari mogu biti u tekućem, krutom i plinovitom stanju. Nastaju od čestica koje se sastoje od atoma. Elementarne molekule mogu imati složenu strukturu, odnosno mogu sadržavati više atoma. Molekule i atomi su električki neutralne čestice koje pod određenim uvjetima dobivaju dodatni električni naboj i postaju pozitivni ili negativni ioni.
- Atomi i molekule se neprestano kreću.
- Čestice s električnom prirodom sile međusobno djeluju jedna na drugu.
Gore su navedene glavne odredbe ICT-a i njihovi primjeri. Između čestica postoji mali gravitacijski utjecaj.
Slika 3. 1 . 1 . Putanja Brownove čestice.
Definicija 2
Brownovo gibanje molekula i atoma potvrđuje postojanje osnovnih principa molekularne kinetičke teorije i eksperimentalno ga potkrepljuje. Ovo toplinsko kretanje čestica događa se s molekulama suspendiranim u tekućini ili plinu.
Eksperimentalno potvrđivanje glavnih odredbi molekularne kinetičke teorije
Godine 1827. R. Brown je otkrio ovo kretanje, koje je bilo uzrokovano nasumičnim udarima i kretanjem molekula. Budući da se proces odvijao kaotično, udarci se nisu mogli uravnotežiti. Iz toga proizlazi zaključak da brzina Brownove čestice ne može biti konstantna, već se stalno mijenja, a usmjereno kretanje je prikazano u obliku cik-cak, prikazano na slici 3. 1 . 1 .
A. Einstein je 1905. godine govorio o Brownovom gibanju. Njegova je teorija potvrđena u pokusima J. Perrina 1908. - 1911. godine.
Definicija 3
Korolar Einsteinove teorije: pomaknuti kvadrat< r 2 >Brownova čestica u odnosu na početnu poziciju, prosječna za mnoge Brownove čestice, proporcionalna je vremenu promatranja t.
Izraz< r 2 >= D t objašnjava zakon difuzije. Prema teoriji, imamo da D monotono raste s porastom temperature. Nasumično kretanje vidljivo je u prisutnosti difuzije.
Definicija 4
Difuzija- ovo je definicija fenomena prodiranja dviju ili više tvari koje dolaze u kontakt jedne s drugom.
Ovaj se proces odvija brzo u heterogenom plinu. Zahvaljujući primjerima difuzije s različitim gustoćama, može se dobiti homogena smjesa. Kada su kisik O2 i vodik H2 u istoj posudi s pregradom, kada se ona ukloni, plinovi se počinju miješati, stvarajući opasnu smjesu. Proces je moguć kada je vodik na vrhu, a kisik na dnu.
Procesi međusobnog prodiranja također se odvijaju u tekućinama, ali puno sporije. Otopimo li krutinu, šećer, u vodi, dobivamo homogenu otopinu, što je zoran primjer difuzijskih procesa u tekućinama. U stvarnim uvjetima, miješanje u tekućinama i plinovima prikriveno je brzim procesima miješanja, na primjer, kada se pojave konvekcijske struje.
Difuziju krutih tvari karakterizira mala brzina. Ako se očisti površina međudjelovanja između metala, vidi se da će se tijekom dužeg vremena u svakom od njih pojaviti atomi drugog metala.
Definicija 5
Difuzija i Brownovo gibanje smatraju se povezanim pojavama.
Kada se čestice obiju tvari međusobno prožimaju, kretanje je nasumično, odnosno uočava se kaotično toplinsko kretanje molekula.
Sile koje djeluju između dviju molekula ovise o udaljenosti između njih. Molekule sadrže pozitivne i negativne naboje. Na velikim udaljenostima prevladavaju sile međumolekularnog privlačenja, a na malim udaljenostima prevladavaju sile odbijanja.
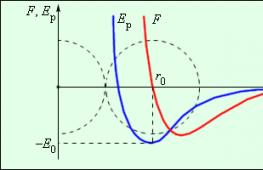
Crtanje 3 . 1 . 2 prikazuje ovisnost rezultirajuće sile F i potencijalne energije E p međudjelovanja među molekulama o udaljenosti njihovih središta. Na udaljenosti r = r 0 međudjelovanje sila postaje nula. Ta se udaljenost konvencionalno uzima kao promjer molekule. Pri r = r 0 potencijalna energija međudjelovanja je minimalna.
Definicija 6
Da biste razmaknuli dvije molekule na udaljenost r 0, trebali biste komunicirati E 0, tzv energija vezanja ili dubina potencijalne jame.

Slika 3. 1 . 2.Moć interakcije F i potencijalna energija interakcije E r dvije molekule. F > 0– odbojna sila, F< 0 - sila gravitacije.
Budući da su molekule male veličine, jednostavne monoatomske ne mogu biti veće od 10 - 10 m. Složene mogu doseći veličine stotine puta veće.
Definicija 7
Nasumično kaotično kretanje molekula naziva se toplinsko kretanje.
Kako temperatura raste, kinetička energija toplinskog gibanja raste. Na niskim temperaturama, prosječna kinetička energija, u većini slučajeva, ispada manja od dubine potencijalne jame E 0 . Ovaj slučaj pokazuje da molekule teku u tekućinu ili krutinu s prosječnom udaljenošću između njih r 0 . Ako temperatura poraste, tada prosječna kinetička energija molekule prelazi E 0, tada se razlijeću i tvore plinovitu tvar.
U krutim tijelima molekule se kreću nasumično oko fiksnih središta, to jest ravnotežnih položaja. U prostoru mogu biti raspoređeni nepravilno (u amorfnim tijelima) ili sa stvaranjem uređenih volumenskih struktura (kristalna tijela).
Agregatna stanja tvari
Sloboda toplinskog gibanja molekula vidljiva je u tekućinama jer nisu vezane za centre, što omogućuje gibanja po cijelom volumenu. To objašnjava njegovu fluidnost.
Definicija 8
Ako su molekule smještene blizu, mogu formirati uređene strukture s nekoliko molekula. Ova pojava se zove poredak kratkog dometa. Dugometni poredak karakterističan za kristalna tijela.
Udaljenost između molekula u plinovima je mnogo veća, pa su sile koje djeluju male, a njihovo kretanje odvija se pravocrtno, čekajući sljedeći sudar. Vrijednost od 10 – 8 m je prosječna udaljenost između molekula zraka u normalnim uvjetima. Budući da je međudjelovanje sila slabo, plinovi se šire i mogu ispuniti bilo koji volumen posude. Kada njihova interakcija teži nuli, govori se o idealnom plinu.
Kinetički model idealnog plina
U μt, količina tvari se smatra proporcionalnom broju čestica.
Definicija 9
Madež- to je količina tvari koja sadrži onoliko čestica (molekula) koliko ima atoma u 0,012 kg ugljika C 12. Molekula ugljika sastoji se od jednog atoma. Iz toga slijedi da 1 mol tvari ima isti broj molekula. Ovaj broj se zove konstantno Avogadro N A: N A = 6,02 ċ 1023 mol – 1.
Formula za određivanje količine tvari ν piše se kao omjer N broja čestica i Avogadrove konstante N A: ν = N N A .
Definicija 10
Masa jednog mola tvari naziva se molarna masa M. Fiksirana je u obliku formule M = N A ċ m 0.
Molarna masa se izražava u kilogramima po molu (kg/mol).
Definicija 11
Ako tvar sadrži jedan atom, tada možemo govoriti o atomskoj masi čestice. Jedinica atoma je 1 12 masa izotopa ugljika C 12, tzv jedinica atomske mase i piše se kao ( A. jesti.): 1 a. e.m. = 1,66 ċ 10 – 27 kg.
Ova vrijednost se podudara s masom protona i neutrona.
Definicija 12
Omjer mase atoma ili molekule određene tvari prema 1 12 masi atoma ugljika naziva se relativna masa.
Ako primijetite grešku u tekstu, označite je i pritisnite Ctrl+Enter
Molekularno kinetička teorija je grana fizike koja proučava svojstva različitih agregatnih stanja, a temelji se na ideji o postojanju molekula i atoma kao najmanjih čestica materije. ICT se temelji na tri glavna principa:
1. Sve tvari sastoje se od sitnih čestica: molekula, atoma ili iona.
2. Ove čestice su u kontinuiranom kaotičnom gibanju, čija brzina određuje temperaturu tvari.
3. Između čestica postoje sile privlačenja i odbijanja, čija priroda ovisi o udaljenosti između njih.
Glavne odredbe ICT-a potvrđuju mnoge eksperimentalne činjenice. Eksperimentalno je dokazano postojanje molekula, atoma i iona, molekule su dovoljno proučene i čak fotografirane elektronskim mikroskopima. Sposobnost plinova da se beskonačno šire i zauzimaju cijeli volumen koji im se pruža objašnjava se kontinuiranim kaotičnim kretanjem molekula. Elastičnost plinova, krutina i tekućina, sposobnost tekućina da nakvase neka krutina, procesi bojenja, lijepljenja, zadržavanja oblika čvrstim tijelima i još mnogo toga ukazuje na postojanje sila privlačenja i odbijanja između molekula. Fenomen difuzije - sposobnost molekula jedne tvari da prodre u prostore između molekula druge - također potvrđuje glavne odredbe MCT-a. Fenomen difuzije objašnjava, na primjer, širenje mirisa, miješanje različitih tekućina, proces otapanja krutih tvari u tekućinama i zavarivanje metala njihovim taljenjem ili pritiskom. Potvrda kontinuiranog kaotičnog gibanja molekula je i Brownovo gibanje – kontinuirano kaotično kretanje mikroskopskih čestica netopivih u tekućini.
Gibanje Brownovih čestica objašnjava se kaotičnim gibanjem tekućih čestica koje se sudaraju s mikroskopskim česticama i pokreću ih. Eksperimentalno je dokazano da brzina Brownovih čestica ovisi o temperaturi tekućine. Teoriju Brownovog gibanja razvio je A. Einstein. Zakoni gibanja čestica su statističke i probabilističke prirode. Postoji samo jedan poznat način smanjenja intenziteta Brownovog gibanja - smanjenje temperature. Postojanje Brownovog gibanja uvjerljivo potvrđuje kretanje molekula.
Svaka tvar sastoji se od čestica, stoga se smatra da je količina tvari v proporcionalna broju čestica, odnosno strukturnih elemenata sadržanih u tijelu.
Jedinica količine tvari je mol. Mol je količina tvari koja sadrži isti broj strukturnih elemenata bilo koje tvari koliko ima atoma u 12 g C12 ugljika. Omjer broja molekula tvari i količine tvari naziva se Avogadrova konstanta:
Avogadrova konstanta pokazuje koliko atoma i molekula sadrži jedan mol tvari. Molarna masa je masa jednog mola tvari, jednaka omjeru mase tvari i količine tvari:
Molarna masa se izražava u kg/mol. Znajući molarnu masu, možete izračunati masu jedne molekule:
Prosječna masa molekula obično se određuje kemijskim metodama, a Avogadrova konstanta se s velikom točnošću određuje pomoću nekoliko fizikalnih metoda. Mase molekula i atoma određuju se sa značajnim stupnjem točnosti pomoću masenog spektrografa.
Mase molekula su vrlo male. Na primjer, masa molekule vode:
Molarna masa je povezana s relativnom molekulskom masom Mg. Relativna molekularna težina je vrijednost koja je jednaka omjeru mase molekule određene tvari prema 1/12 mase C12 ugljikovog atoma. Ako je poznata kemijska formula tvari, pomoću periodnog sustava može se odrediti njezina relativna masa, koja, izražena u kilogramima, pokazuje molarnu masu te tvari.
Molekularno kinetička teorija je grana fizike koja proučava svojstva različitih agregatnih stanja, a temelji se na ideji o postojanju molekula i atoma kao najmanjih čestica materije. ICT se temelji na tri glavna principa:
1. Sve tvari sastoje se od sitnih čestica: molekula, atoma ili iona.
2. Ove čestice su u kontinuiranom kaotičnom gibanju, čija brzina određuje temperaturu tvari.
3. Između čestica postoje sile privlačenja i odbijanja, čija priroda ovisi o udaljenosti između njih.
Glavne odredbe ICT-a potvrđuju mnoge eksperimentalne činjenice. Eksperimentalno je dokazano postojanje molekula, atoma i iona, molekule su dovoljno proučene i čak fotografirane elektronskim mikroskopima. Sposobnost plinova da se beskonačno šire i zauzimaju svi volumen koji on osigurava objašnjava se kontinuiranim kaotičnim kretanjem molekula. Elastičnost plinovi, krutine i tekućine, sposobnost tekućina
vlaženje nekih krutina, procesi bojanja, lijepljenja, održavanja oblika krutinama i još mnogo toga ukazuje na postojanje sila privlačenja i odbijanja između molekula. Fenomen difuzije - sposobnost molekula jedne tvari da prodre u prostore između molekula druge - također potvrđuje glavne odredbe MCT-a. Fenomen difuzije objašnjava, na primjer, širenje mirisa, miješanje različitih tekućina, proces otapanja krutih tvari u tekućinama i zavarivanje metala njihovim taljenjem ili pritiskom. Potvrda kontinuiranog kaotičnog gibanja molekula je i Brownovo gibanje – kontinuirano kaotično kretanje mikroskopskih čestica netopivih u tekućini.
Gibanje Brownovih čestica objašnjava se kaotičnim gibanjem tekućih čestica koje se sudaraju s mikroskopskim česticama i pokreću ih. Eksperimentalno je dokazano da brzina Brownovih čestica ovisi o temperaturi tekućine. Teoriju Brownovog gibanja razvio je A. Einstein. Zakoni gibanja čestica su statističke i probabilističke prirode. Postoji samo jedan poznat način smanjenja intenziteta Brownovog gibanja - smanjenje temperature. Postojanje Brownovog gibanja uvjerljivo potvrđuje kretanje molekula.
Svaka se tvar sastoji od čestica, dakle količina tvari smatra se da je proporcionalan broju čestica, tj. strukturnih elemenata sadržanih u tijelu, v.
Jedinica količine tvari je madež.Madež- ovo je količina tvari koja sadrži isti broj strukturnih elemenata bilo koje tvari koliko ima atoma u 12 g ugljika C 12. Omjer broja molekula tvari i količine tvari naziva se Avogadrova konstanta:
n a= N/ v. na = 6,02 10 23 madež -1 .
Avogadrova konstanta pokazuje koliko atoma i molekula sadrži jedan mol tvari. Molekulska masa je veličina jednaka omjeru mase tvari i količine tvari:
M = m/ v.
Molarna masa se izražava u kg/mol. Znajući molarnu masu, možete izračunati masu jedne molekule:
m 0 = m/N = m/vN A= M/ N A
Prosječna masa molekula obično se određuje kemijskim metodama, a Avogadrova konstanta se s velikom točnošću određuje pomoću nekoliko fizikalnih metoda. Mase molekula i atoma određuju se sa značajnim stupnjem točnosti pomoću masenog spektrografa.
Mase molekula su vrlo male. Na primjer, masa molekule vode: t = 29,9 10 -27 kg.
Molarna masa je povezana s relativnom molekularnom masom Mr. Relativna molarna masa je vrijednost koja je jednaka omjeru mase molekule dane tvari prema 1/12 mase C 12 ugljikovog atoma. Ako je poznata kemijska formula tvari, pomoću periodnog sustava može se odrediti njezina relativna masa, koja, izražena u kilogramima, pokazuje molarnu masu te tvari.