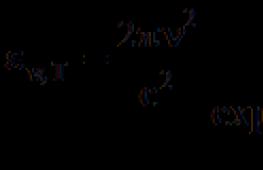Aatomi spektrid. Jadavalemid
Ernest Rutherford (1871-1937).
Inglise füüsik, tuumafüüsika asutaja, Londoni Kuningliku Seltsi liige (1903, president aastatel 1925-1930) ja enamiku akadeemiate üle maailma. Sündis Brightwateris (Uus-Meremaa). 1899. aastal avastas alfa- ja beetakiired 1900. aastal - raadiumi lagunemisprodukt (emanatsioon) ja tutvustas poolestusaja mõistet. Koos F. Soddyga 1902. - 1903. a. töötas välja radioaktiivse lagunemise teooria ja kehtestas radioaktiivsete muundumiste seaduse. Aastal 1903 tõestas, et alfakiired koosnevad positiivselt laetud osakestest (Nobeli keemiaauhind, 1908).
Aastal 1908 konstrueeris koos G. Geigriga üksikute laetud osakeste salvestamise seadme (Geigeri loendur). Paigaldatud 1911. aastal alfaosakeste hajumise seadus erinevate elementide aatomite järgi (Rutherfordi valem), mis võimaldas 1911. aastal luua aatomi uue mudeli – planetaarse (Rutherfordi mudel).
Ta esitas aatomituumade kunstliku muundamise idee (1914). 1919. aastal viis läbi esimese kunstliku tuumareaktsiooni, muutes lämmastiku hapnikuks, pannes sellega aluse ühisele tuumafüüsikale, avastas prootoni. 1920. aastal ennustas neutroni ja deuteroni olemasolu. Koos M. Oliphantiga tõestas ta seda 1933. aastal eksperimentaalselt. Massi ja energia vahelise seose seaduse kehtivus tuumareaktsioonides. 1934. aastal viis läbi deuteroonide ühinemisreaktsiooni triitiumi moodustumisega.
Esimesed katsed aatomi struktuuri uurimiseks tegi Ernest Rutherford 1911. aastal. Need said võimalikuks tänu radioaktiivsuse nähtuse avastamisele, mille käigus loodusliku radioaktiivse lagunemise tulemusena vabanevad rasked elemendid. -osakesed. Selgus, et nende osakeste positiivne laeng on võrdne kahe elektroni laenguga, nende mass on ligikaudu 4 korda suurem kui vesinikuaatomi mass, s.t. need on heeliumi aatomi ioonid (). Osakeste energia varieerub eV uraani puhul eV tooriumi puhul. Osakeste kiirus on m/s, seega saab nendega õhukesest metallfooliumist “läbi tulistada”. Teave osakeste hajumise kohta on näidatud joonisel fig. 1.

Uuringud on näidanud, et väike hulk osakesi kaldus oluliselt kõrvale algsest liikumissuunast. Mõnel juhul oli hajumise nurk 180 kraadi lähedal. Saadud andmete põhjal tegi E. Rutherford järeldused, mis olid aluseks aatomi planetaarmudel:
On tuum, milles on koondunud peaaegu kogu aatomi mass ja kogu selle positiivne laeng ning tuuma mõõtmed on palju väiksemad kui aatomi enda mõõtmed;
Aatomi moodustavad elektronid liiguvad ümber tuuma ringikujulistel orbiitidel.
Nendele kahele eeldusele tuginedes ja eeldades, et langeva osakese ja positiivselt laetud tuuma vastastikmõju määravad Coulombi jõud, tegi Rutherford kindlaks, et aatomituumadel on mõõtmed ()m, s.o. need on () korda väiksemad kui aatomite suurus.
Rutherfordi pakutud aatomi mudel meenutab päikesesüsteemi, s.t. aatomi keskel on tuum ("Päike") ja elektronid - "planeedid" - liiguvad selle ümber orbiitidel. Seetõttu kutsuti Rutherfordi mudelit planetaarne aatomimudel.
See mudel oli samm edasi tänapäevase arusaamise suunas aatomi struktuurist. Aluskontseptsioon aatomituum, milles aatomi kogu positiivne laeng ja peaaegu kogu selle mass on kontsentreeritud, on säilitanud oma tähenduse tänapäevani.
Küll aga eeldus, et elektronid liiguvad ringikujulistel orbiitidel kokkusobimatu ei klassikalise elektrodünaamika seadustega ega ka aatomigaaside emissioonispektrite joonelise olemusega.
Illustreerime Rutherfordi planeedimudeli kohta öeldut vesinikuaatomi näitel, mis koosneb massiivsest tuumast (prootonist) ja selle ümber ringorbiidil liikuvast elektronist. Alates orbiidi raadiusest ![]() m (esimene Bohri orbiit) ja elektronide kiirus m/s, selle normaalne kiirendus
m (esimene Bohri orbiit) ja elektronide kiirus m/s, selle normaalne kiirendus  . Ringikujulisel orbiidil kiirendusega liikuv elektron on kahemõõtmeline ostsillaator. Seetõttu peaks see klassikalise elektrodünaamika järgi kiirgama energiat elektromagnetlaine kujul. Selle tulemusena läheneb elektron paratamatult tuumale ajas s. Kuid tegelikult on vesinikuaatom stabiilne ja "pikaealine" elektromehaaniline süsteem.
. Ringikujulisel orbiidil kiirendusega liikuv elektron on kahemõõtmeline ostsillaator. Seetõttu peaks see klassikalise elektrodünaamika järgi kiirgama energiat elektromagnetlaine kujul. Selle tulemusena läheneb elektron paratamatult tuumale ajas s. Kuid tegelikult on vesinikuaatom stabiilne ja "pikaealine" elektromehaaniline süsteem.
Klassikalised katsed aatomi struktuuri uurimisel viis läbi Sir Ernest Rutherford 1911. aastal. Rutherford viis läbi katsed, et uurida alfaosakeste hajumist õhukeste metallfooliumi lehtede poolt. Löök aatomitele viidi läbi, pommitades neid massiivsete osakeste kiirega. Eksperimentaalne diagramm on näidatud joonisel fig. 1.
Õhuke kuldfoolium F (fooliumi paksus oli umbes 10–7 m, see sisaldas umbes 400 aatomit) asetati sfäärilise ekraani E sisse. Läbi ekraani ava sisaldas radioaktiivse ravimi poolt kiiratud kiirete alfaosakeste kiir. pliimahutis langes risti plaadile R. Alfaosakesed on täielikult ioniseeritud heeliumiaatom massiga 4,0015 amü. ja laeng on võrdne + 2e
 (e on elementaarelektrilaengu väärtus). Alfaosakese kiirus oli suurusjärgus 10 7 m/s, energia 4,05 MeV. Kui fooliumi paksus on väike, on alfaosakeste kokkupõrge peaaegu ühekordne, s.t. Iga osake põrkab kokku ainult ühe aatomiga, muutes oma lennu suunda.
(e on elementaarelektrilaengu väärtus). Alfaosakese kiirus oli suurusjärgus 10 7 m/s, energia 4,05 MeV. Kui fooliumi paksus on väike, on alfaosakeste kokkupõrge peaaegu ühekordne, s.t. Iga osake põrkab kokku ainult ühe aatomiga, muutes oma lennu suunda.
Ekraani siseseinad olid kaetud fosforiga – ainega, milles alfaosakeste pihta sattus sähvatus. See võimaldas registreerida M-seadmega alfaosakesi, mis olid hajutatud aatomite poolt algsest suunast erinevate nurkade all θ. Alfaosakeste hajumise katsed võimaldasid tuvastada järgmised mustrid.
1. Valdav enamus alfaosakesi läbib fooliumi peaaegu vabalt: need ei kaldu kõrvale ega kaota energiat.
2. Ainult väike osa osakestest (≈ 0,01%, see tähendab üks kümnetuhandik) pöördus tagasi, st muutis liikumissuunda nurga võrra, mis oli suurem kui 90 kraadi.
Rutherfordi katsete tulemusi saab selgitada eeldusel, et kogu positiivne laeng ja peaaegu kogu aatomi mass on koondunud aatomi väikesesse piirkonda - tuuma, mille mõõtmed on umbes 10 -14 m Negatiivselt laetud elektronid liiguvad ümber tuuma tohutul (tuumaga võrreldes) alal, mille suurus on umbes 10-10 m.
See oletus on aluseks aatomi tuumamudel, mida nimetatakse ka planetaarseks. Elektronide arv aatomis on võrdne elemendi aatomnumbriga Mendelejevi perioodilisustabelis. Lisaks näidati, et elektrone tuumaga ühendavad jõud alluvad Coulombi seadusele.
Tuumamudel on aga vastuolus klassikalise elektrodünaamika seadustega. Tegelikult, kui elektron on aatomis puhkeasendis, peab see Coulombi tõmbejõu mõjul tuumale langema. Kui elektron tiirleb ümber tuuma, peaks see kiirgama elektromagnetvälja. Samal ajal kaotab see kiirguse kaudu oma energiat, liikumiskiirus väheneb ja elektron peab lõpuks langema tuumale. Aatomite emissioonispektrid peaksid sel juhul olema pidevad ja aatomi eluiga ei tohiks ületada 10-7 s. Tegelikult on aatomid stabiilsed ja aatomite emissioonispektrid on diskreetsed.
Arvutiprogramm simuleerib Rutherfordi klassikalist katset aatomi sondeerimisel alfaosakestega, mille tulemuste põhjal tehti ettepanek aatomi struktuuri planetaarne mudel .
Esimesed otsesed katsed aatomite sisestruktuuri uurimiseks viisid läbi E. Rutherford ning tema kaastöötajad E. Marsden ja H. Geiger aastatel 1909–1911.
Rutherford tegi ettepaneku kasutada aatomsondeerimist, kasutades raadiumi ja mõne muu elemendi radioaktiivse lagunemise käigus tekkivaid α-osakesi. Alfaosakeste mass on ligikaudu 7300 korda suurem elektroni massist ja positiivne laeng võrdub kahekordse elementaarlaenguga. Rutherford kasutas oma katsetes α-osakesi, mille kineetiline energia on umbes 5 MeV (selliste osakeste kiirus on väga suur – umbes 107 m/s, kuid siiski oluliselt väiksem kui valguse kiirus).
α osakesed on täielikult ioniseeritud heeliumi aatomid. Need avastas Rutherford 1899. aastal radioaktiivsuse fenomeni uurides. Rutherford pommitas nende osakestega raskete elementide (kuld, hõbe, vask jne) aatomeid. Aatomeid moodustavad elektronid ei saa oma väikese massi tõttu märgatavalt muuta α-osakese trajektoori. Hajumist ehk α-osakeste liikumissuuna muutumist saab põhjustada ainult aatomi raske, positiivselt laetud osa. Rutherfordi katse diagramm on näidatud joonisel fig. 1.
Pliimahutisse suletud radioaktiivsest allikast suunati alfaosakesed õhukesele metallfooliumile. Hajutatud osakesed langesid ekraanile, mis oli kaetud tsinksulfiidi kristallide kihiga, mis on võimeline kiirlaetud osakeste tabamisel hõõguma. Ekraanil olevaid stsintillatsioone (sähvatusi) jälgiti silmaga mikroskoobi abil. Hajutatud α osakeste vaatlusi Rutherfordi katses sai läbi viia erinevate nurkade all φ kiire algse suuna suhtes. Leiti, et enamik α osakesi läbis õhukese metallikihi vähese või ilma läbipaindeta. Väike osa osakestest kaldub aga kõrvale märkimisväärse nurga all, mis ületab 30°. Väga haruldased alfaosakesed (umbes üks kümnest tuhandest) kaldusid kõrvale 180° lähedase nurga all.
Rutherfordi ja tema kolleegide katsed jõudsid järeldusele, et aatomi keskmes on tihe positiivselt laetud tuum, mille läbimõõt ei ületa 10–14–10–15 m. See tuum võtab enda alla vaid 10–12 m aatomi kogumahust, kuid sisaldab kõik positiivne laeng ja vähemalt 99,95% selle massist. Tuuma laeng peab olema võrdne kõigi aatomit moodustavate elektronide kogulaenguga.
Tuginedes klassikalistele ideedele mikroosakeste liikumise kohta, tegi Rutherford ettepaneku aatomi planetaarmudel . Selle mudeli järgi on aatomi keskmes positiivselt laetud tuum, millesse on koondunud peaaegu kogu aatomi mass. Aatom tervikuna on neutraalne. Elektronid pöörlevad ümber tuuma, nagu planeedid, tuumast lähtuvate Coulombi jõudude mõjul. Elektronid ei saa olla puhkeolekus, kuna nad kukuvad tuumale.
Rutherfordi aatomi planetaarmudel oli suur samm edasi aatomi ehitust puudutavate teadmiste arendamisel. Absoluutselt oli vaja selgitada α-osakeste hajumise katseid, kuid selgus, et see ei suutnud seletada aatomi pika eksisteerimise fakti, st selle stabiilsust. Klassikalise elektrodünaamika seaduste kohaselt peaks kiirendusega liikuv laeng kiirgama elektromagnetlaineid, mis kannavad energiat. Lühikese aja jooksul (umbes 10–8 s) peavad kõik Rutherfordi aatomi elektronid raiskama kogu oma energia ja langema tuuma. Asjaolu, et seda ei juhtu aatomi stabiilsetes olekutes, näitab, et aatomi sisemised protsessid ei allu klassikalistele seadustele.
Kasutajal on võimalus:
- jälgida statsionaarsel kullasüdamikul olevate osakeste hajumist;
- muuta osakese löögikaugust ja algkiirust;
- mõõta osakeste hajumise nurka;
- uurige hajumise kõverat kullatuuma pommitamisel automaatrežiimis antud energiaga osakeste vooluga.
A loid liiges e spektrid, optilised spektrid, mis tulenevad valguse (elektromagnetlainete) kiirgamisest või neeldumisest vabade või nõrgalt seotud aatomite poolt; Sellised spektrid on eriti monoatomilistel gaasidel ja aurudel. A. s. on vooderdatud – koosnevad üksikutest spektrijoontest. A. s. on täheldatud heledate värviliste joonte kujul, kui gaasid või aurud hõõguvad elektrikaares või -lahenduses (emissioonispektrid) ja tumedate joontena (absorptsioonispektrid). Iga spektrijoont iseloomustab väljastatava või neelduva valguse teatud võnkesagedus v ja see vastab teatud kvantüleminekule aatomi energiatasemete E i ja E k vahel vastavalt seosele: hv = E i - E k, kus h on Plancki konstant). Koos sagedusega saab spektrijoont iseloomustada lainepikkusega l = c/v, lainearvuga 1/l = v/c (c on valguse kiirus) ja footoni energiaga hv.
A. s. tekivad üleminekul aatomi välimiste elektronide energiatasemete vahel ja neid täheldatakse nähtavas, ultraviolett- ja lähiinfrapuna piirkonnas. Nii neutraalsetel kui ka ioniseeritud aatomitel on sellised spektrid; neid nimetatakse sageli vastavalt kaare- ja sädespektriteks (neutraalsed aatomid ergastuvad kergesti ja annavad elektrikaares emissioonispektreid, positiivseid ioone on aga raskem ergutada ja need annavad emissioonispektreid valdavalt sädeelektrilahendustes). Ioniseeritud aatomite spektrid on neutraalsete aatomite spektrite suhtes nihkunud kõrgema sagedusega piirkonda, st ultraviolettkiirguse piirkonda. See nihe on suurem, mida suurem on aatomi ionisatsioonikiirus – seda rohkem elektrone on ta kaotanud. Neutraalse aatomi ja selle järjestikuste ioonide spektrid on spektroskoopias tähistatud numbritega I, II, III, ... Tegelikult vaadeldavates spektrites esinevad neutraalsete ja ioniseeritud aatomite jooned sageli samaaegselt; Nii räägivad nad näiteks raua spektri FeI, FeII, FeIII joonte kohta, mis vastavad Fe, Fe +, Fe 2+.
Liinid A. s. moodustavad regulaarsed rühmad, mida nimetatakse spektraalridadeks. Jada joonte vahed vähenevad lühemate lainepikkuste suunas ja jooned lähenevad seeria piiri poole. Lihtsaim spekter on vesinikuaatom. Selle spektri joonte lainenumbrid määratakse suure täpsusega Balmeri valemiga:
1/l = R(1/n21 - 1/n22), kus n 1 ja n 2 peamise kvantarvu väärtust energiatasemete jaoks, mille vahel toimub kvantüleminek
Rutherford tegi ettepaneku kasutada aatomsondeerimist, kasutades raadiumi ja mõne muu elemendi radioaktiivse lagunemise käigus tekkivaid a-osakesi. β-osakeste mass on ligikaudu 7300 korda suurem kui elektroni mass ja positiivne laeng võrdub kahekordse elementaarlaenguga. Rutherford kasutas oma katsetes?-osakesi, mille kineetiline energia on umbes 5 MeV (selliste osakeste kiirus on väga suur - umbes 107 m/s, kuid see on siiski oluliselt väiksem kui valguse kiirus). a-osakesed on täielikult ioniseeritud heeliumi aatomid. Rutherford pommitas nende osakestega raskete elementide (kuld, hõbe, vask jne) aatomeid. Aatomeid moodustavad elektronid ei saa oma väikese massi tõttu osakese trajektoori märgatavalt muuta. Hajumist ehk?-osakeste liikumissuuna muutumist saab põhjustada ainult aatomi raske, positiivselt laetud osa.
Pliimahutisse suletud radioaktiivsest allikast suunati γ osakesed õhukesele metallfooliumile. Hajutatud osakesed langesid ekraanile, mis oli kaetud tsinksulfiidi kristallide kihiga, mis on võimeline kiirlaetud osakeste tabamisel hõõguma. Ekraanil esinevaid sähvatusi jälgiti silmaga mikroskoobi abil. Leiti, et enamik β osakesi läbib õhukese metallikihi praktiliselt ilma läbipaindeta. Väike osa osakestest kaldub aga kõrvale märkimisväärse nurga all, mis ületab 30°. Väga harvaesinevad a-osakesed (ligikaudu üks kümnest tuhandest) kogesid läbipaindeid 180° lähedase nurga all.
See tulemus oli isegi Rutherfordi jaoks täiesti ootamatu. See oli teravas vastuolus Thomsoni aatomimudeliga, mille kohaselt positiivne laeng jaotub kogu aatomi ruumala ulatuses. Sellise jaotuse korral ei saa positiivne laeng tekitada tugevat elektrivälja, mis oleks võimeline a-osakesi tagasi paiskama. Rutherford jõudis järeldusele, et aatom oli peaaegu tühi ja kogu selle positiivne laeng oli kontsentreeritud väikeses mahus. Rutherford nimetas seda aatomi osa aatomituumaks. Nii tekkis aatomi tuumamudel. Varsti, tuginedes klassikalistele ideedele mikroosakeste liikumise kohta, pakkus Rutherford välja aatomi planeedimudeli. Selle mudeli järgi on aatomi keskmes positiivselt laetud tuum, millesse on koondunud peaaegu kogu aatomi mass. Aatom tervikuna on neutraalne. Elektronid pöörlevad ümber tuuma, nagu planeedid, tuumast lähtuvate Coulombi jõudude mõjul. Elektronid ei saa olla puhkeolekus, kuna nad kukuvad tuumale.
Bohri postulaadid.
Bohri postulaadid:
Aatomil on statsionaarsed olekud, milles see ei eralda energiat. Selliste olekute korral peavad ringorbiidil liikuval aatomis oleval elektronil olema nurkimpulsi kvantiseeritud väärtused, mis vastavad tingimusele: kus m0 on elektroni mass, V on selle liikumise kiirus orbiidil raadius r ja on Plancki konstant.
Kui aatom läheb üle statsionaarsest olekust numbriga n statsionaarsesse olekusse numbriga m, kiirgab või neeldub üks energiaga footon:
kus Еn ja Еm on elektroni energia vastavatel orbiitidel.
Ernest Rutherford on üks aatomi sisestruktuuri põhidoktriini rajajaid. Teadlane sündis Inglismaal Šotimaalt pärit immigrantide perekonnas. Rutherford oli oma pere neljas laps ja osutus kõige andekamaks. Tal õnnestus anda eriline panus aatomistruktuuri teooriasse.
Esialgsed ideed aatomi struktuuri kohta
Tuleb märkida, et enne Rutherfordi kuulsa alfaosakeste hajumise katse läbiviimist oli tol ajal domineerivaks ideeks aatomi struktuuri kohta Thompsoni mudel. See teadlane oli kindel, et positiivne laeng täitis ühtlaselt kogu aatomi ruumala. Thompson uskus, et negatiivselt laetud elektronid olid selle vahele justkui segatud.

Teadusrevolutsiooni eeldused
Pärast koolist lahkumist sai Rutherford kui kõige andekam õpilane edasiõppimiseks 50 naela. Tänu sellele sai ta minna Uus-Meremaa kolledžisse. Järgmiseks sooritab noor teadlane Canterbury ülikoolis eksamid ning hakkab tõsiselt õppima füüsikat ja keemiat. 1891. aastal pidas Rutherford oma esimese ettekande teemal "Elementide evolutsioon". Esimest korda ajaloos visandas see idee, et aatomid on keerulised struktuurid.
Sel ajal domineeris teadusringkondades Daltoni idee, et aatomid on jagamatud. Kõigile Rutherfordi ümber tundus tema idee täiesti hullumeelne. Noor teadlane pidi pidevalt kolleegide ees vabandama oma "lolluste" pärast. Kuid pärast 12 aastat suutis Rutherford siiski tõestada, et tal oli õigus. Rutherfordil oli võimalus jätkata uurimistööd Inglismaal Cavendishi laboris, kus ta asus uurima õhu ionisatsiooni protsesse. Rutherfordi esimene avastus oli alfa- ja beetakiired.

Rutherfordi kogemus
Avastust võib lühidalt kirjeldada järgmiselt: 1912. aastal viis Rutherford koos oma abilistega läbi oma kuulsa katse – pliiallikast paisati välja alfaosakesed. Kõik osakesed, välja arvatud need, mida plii neelas, liikusid mööda paigaldatud kanalit. Nende kitsas oja langes õhukesele fooliumikihile. See joon oli lehe suhtes risti. Rutherfordi alfaosakeste hajumise katse tõestas, et need osakesed, mis läksid otse läbi fooliumilehe, tekitasid ekraanil niinimetatud stsintillatsioone.
See ekraan oli kaetud spetsiaalse ainega, mis hakkas helendama, kui alfaosakesed seda tabasid. Kuldfooliumikihi ja ekraani vaheline ruum täideti vaakumiga, et vältida alfaosakeste õhku hajumist. Selline seade võimaldas teadlastel jälgida osakeste hajumist umbes 150° nurga all.
Kui fooliumit alfaosakeste kiire ees takistuseks ei kasutatud, siis tekkis ekraanile kerge stsintillatsioonide ring. Kuid niipea, kui nende tala ette pandi kuldfooliumist barjäär, muutus pilt suuresti. Välgud ei ilmunud mitte ainult väljaspool seda ringi, vaid ka fooliumi vastasküljele. Rutherfordi alfaosakeste hajumise katse näitas, et enamik osakesi läbis fooliumi ilma märgatavate trajektoori muutusteta.
Sel juhul kaldusid mõned osakesed üsna suure nurga all kõrvale ja paiskusid isegi tagasi. Iga 10 000 kuldfooliumikihti vabalt läbinud osakese kohta kaldus ainult üks osake nurgaga, mis ületas 10° – erandina kaldus üks osake sellise nurga all kõrvale.

Põhjus, miks alfaosakesed kõrvale kalduti
See, mida Rutherfordi katse üksikasjalikult uuris ja tõestas, on aatomi struktuur. See olukord näitas, et aatom ei ole pidev moodustis. Enamik osakesi läbis vabalt ühe aatomi paksuse fooliumi. Ja kuna alfaosakese mass on ligi 8000 korda suurem kui elektroni mass, ei saanud viimane alfaosakese trajektoori oluliselt mõjutada. Seda saab teha ainult aatomituum - väikese suurusega keha, millel on peaaegu kogu aatomi mass ja kogu elektrilaeng. Sel ajal oli see inglise füüsiku jaoks oluline läbimurre. Rutherfordi kogemusi peetakse üheks olulisemaks sammuks aatomi siseehituse teaduse arengus.
Muud aatomi uurimise käigus tehtud avastused
Need uuringud andsid otseseid tõendeid selle kohta, et aatomi positiivne laeng asub selle tuumas. See ala võtab selle üldmõõtmetega võrreldes väga väikese ruumi. Nii väikeses mahus osutus alfaosakeste hajumine väga ebatõenäoliseks. Ja need osakesed, mis möödusid aatomituuma piirkonna lähedalt, kogesid trajektoorist teravaid kõrvalekaldeid, kuna alfaosakese ja aatomituuma vahelised tõukejõud olid väga võimsad. Rutherfordi alfaosakeste hajumise katse tõestas tõenäosust, et alfaosake tabab otse tuuma. Tõsi, tõenäosus oli väga väike, kuid siiski mitte null.
See polnud ainus fakt, mida Rutherfordi kogemus tõestas. Aatomi ehitust uurisid põgusalt tema kolleegid, kes tegid veel mitmeid olulisi avastusi. Välja arvatud õpetus, et alfaosakesed on kiiresti liikuvad heeliumi tuumad.
Teadlane suutis kirjeldada aatomi struktuuri, milles tuum hõivab väikese osa kogumahust. Tema katsed tõestasid, et peaaegu kogu aatomi laeng on koondunud selle tuuma sisse. Sel juhul esinevad nii alfaosakeste läbipaine kui ka nende tuumaga kokkupõrke juhtumid.

Rutherfordi katsed: aatomi tuumamudel
1911. aastal pakkus Rutherford pärast arvukaid uuringuid välja aatomi struktuuri mudeli, mida ta nimetas planetaarseks. Selle mudeli järgi on aatomi sees tuum, mis sisaldab peaaegu kogu osakese massi. Elektronid liiguvad ümber tuuma sarnaselt sellele, kuidas planeedid liiguvad ümber Päikese. Nende kombinatsioonist moodustub nn elektronipilv. Aatomil on neutraalne laeng, nagu näitas Rutherfordi katse.
Aatomi struktuur hakkas hiljem huvi tundma Niels Bohri nimelise teadlase vastu. Just tema viis Rutherfordi õpetuse lõpule, sest enne Bohri hakkas aatomi planeedimudelil ilmnema seletamisraskusi. Kuna elektron liigub ümber tuuma kindlal orbiidil kiirendusega, siis varem või hiljem peab ta langema aatomi tuumale. Niels Bohr suutis aga tõestada, et aatomi sees klassikalise mehaanika seadused enam ei kehti.