Tehke oletus asendus-lisamis-eliminatsiooni reaktsioonide kohta. Keemiliste reaktsioonide tüübid orgaanilises keemias
Orgaaniliste ainete reaktsioonid võib formaalselt jagada nelja põhiliiki: asendamine, lisamine, elimineerimine (eliminatsioon) ja ümberkorraldamine (isomerisatsioon). On ilmne, et orgaaniliste ühendite reaktsioonide kogu mitmekesisust ei saa taandada kavandatud klassifikatsiooni raamistikku (näiteks põlemisreaktsioonid). Selline klassifikatsioon aitab aga luua analoogiaid anorgaaniliste ainete vahel toimuvate reaktsioonide klassifikatsioonidega, mis on teile anorgaanilise keemia kursusest juba tuttavad.
Tavaliselt nimetatakse reaktsioonis osalevat peamist orgaanilist ühendit substraadiks ja reaktsiooni teist komponenti peetakse tavapäraselt reagendiks.
Asendusreaktsioonid
Reaktsioone, mille tulemuseks on ühe aatomi või aatomirühma asendamine algses molekulis (substraadis) teiste aatomite või aatomirühmadega, nimetatakse asendusreaktsioonideks.
Asendusreaktsioonid hõlmavad küllastunud ja aromaatseid ühendeid, nagu alkaanid, tsükloalkaanid või areenid.
Toome näiteid sellistest reaktsioonidest.
Valguse mõjul saab metaani molekulis vesinikuaatomeid asendada halogeeniaatomitega, näiteks klooriaatomitega:
CH4 + Cl2 → CH3Cl + HCl
Veel üks näide vesiniku asendamisest halogeeniga on benseeni muundamine bromobenseeniks:
Selle kirjutusviisi puhul on reaktiivid, katalüsaator ja reaktsioonitingimused kirjutatud noole kohale ning anorgaanilised reaktsiooniproduktid selle alla.
Lisamisreaktsioonid
Reaktsioone, mille käigus kaks või enam reageeriva aine molekuli ühinevad üheks, nimetatakse liitumisreaktsioonideks.
Küllastumata ühendid, nagu alkeenid või alküünid, läbivad liitumisreaktsiooni. Sõltuvalt sellest, milline molekul toimib reagendina, eristatakse hüdrogeenimist (või redutseerimist), halogeenimist, hüdrohalogeenimist, hüdratatsiooni ja muid liitumisreaktsioone. Igaüks neist nõuab teatud tingimusi.
1 . Hüdrogeenimine - vesiniku molekuli lisamise reaktsioon läbi mitmiksideme:
CH3-CH = CH2 + H2 → CH3-CH2-CH3
propeenpropaan
2 . Hüdrohalogeenimine - vesinikhalogeniidi liitumisreaktsioon (näiteks hüdrokloorimine):
CH2=CH2 + HCl → CH3-CH2-Cl
eteen kloroetaan
3 . Halogeenimine - halogeeni lisamise reaktsioon (näiteks kloorimine):
CH2=CH2 + Cl2 → CH2Cl-CH2Cl
eteen 1,2-dikloroetaan
4 . Polümerisatsioon - liitumisreaktsiooni eriliik, mille käigus väikese molekulmassiga aine molekulid ühinevad üksteisega, moodustades väga suure molekulmassiga aine molekule - makromolekule.
Polümerisatsioonireaktsioonid - need on paljude madala molekulmassiga aine (monomeeri) molekulide ühendamine polümeeri suurteks molekulideks (makromolekulideks).
Polümerisatsioonireaktsiooni näide on polüetüleeni tootmine etüleenist (eteenist) ultraviolettkiirguse ja radikaalse polümerisatsiooni initsiaatori R toimel.
Keemiliste reaktsioonide tüübid orgaanilises keemias
Eliminatsiooni reaktsioonid
Reaktsioone, mille tulemusena moodustuvad algse ühendi molekulist mitme uue aine molekulid, nimetatakse elimineerimis- või elimineerimisreaktsioonideks.
Selliste reaktsioonide näideteks on etüleeni tootmine erinevatest orgaanilistest ainetest.

Keemiliste reaktsioonide tüübid orgaanilises keemias
Erilise tähtsusega eliminatsioonireaktsioonide hulgas on süsivesinike termilise lõhustamise reaktsioon, millel põhineb alkaanide krakkimine - kõige olulisem tehnoloogiline protsess:

Enamasti viib väikese molekuli lõhustamine lähteaine molekulist täiendava n-sideme moodustumiseni aatomite vahel. Eliminatsioonireaktsioonid toimuvad teatud tingimustel ja teatud reagentidega. Antud võrrandid kajastavad ainult nende teisenduste lõpptulemust.
Isomerisatsioonireaktsioonid
Reaktsioone, mille tulemusena moodustuvad ühe aine molekulid teiste sama kvalitatiivse ja kvantitatiivse koostisega, st sama molekulvalemiga ainete molekulidest, nimetatakse isomerisatsioonireaktsioonideks.
Sellise reaktsiooni näide on lineaarsete alkaanide süsiniku karkassi isomerisatsioon hargnenud ahelateks, mis toimub alumiiniumkloriidil kõrgel temperatuuril:
Keemiliste reaktsioonide tüübid orgaanilises keemias
1 . Mis tüüpi reaktsioon see on:
a) klorometaani saamine metaanist;
b) bromobenseeni saamine benseenist;
c) kloroetaani tootmine etüleenist;
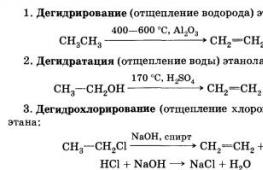
d) etüleeni tootmine etanoolist;
e) butaani muundamine isobutaaniks;
f) etaandehüdrogeenimine;
g) bromoetaani muundamine etanooliks?
2 . Millised reaktsioonid on tüüpilised: a) alkaanidele; b) alkeenid? Too näiteid reaktsioonidest.
3 . Millised on isomeerimisreaktsioonide omadused? Mis on neil ühist reaktsioonidega, mis tekitavad ühe keemilise elemendi allotroopseid modifikatsioone? Too näiteid.
4. Millistes reaktsioonides (lisamine, asendamine, elimineerimine, isomerisatsioon) on lähteühendi molekulmass:
a) suureneb;
b) väheneb;
c) ei muutu;
d) kas see suureneb või väheneb sõltuvalt reaktiivist?
Paljud asendusreaktsioonid avavad tee mitmesuguste ühendite tootmiseks, millel on majanduslik rakendus. Elektrofiilne ja nukleofiilne asendus mängib keemiateaduses ja -tööstuses tohutut rolli. Orgaanilise sünteesi puhul on neil protsessidel mitmeid tunnuseid, millele tuleks tähelepanu pöörata.
Keemiliste nähtuste mitmekesisus. Asendusreaktsioonid
Ainete muundumisega seotud keemilised muutused eristuvad mitmete tunnuste poolest. Lõpptulemused ja termilised mõjud võivad erineda; Mõned protsessid lähevad lõpuni, teistes toimub ainete muutus, millega sageli kaasneb oksüdatsiooniastme suurenemine või vähenemine. Keemiliste nähtuste klassifitseerimisel lõpptulemuse järgi pööratakse tähelepanu reaktiivide ja toodete kvalitatiivsetele ja kvantitatiivsetele erinevustele. Nende tunnuste põhjal saab eristada 7 tüüpi keemilisi muundumisi, sealhulgas asendust, mis järgib skeemi: A-B + C A-C + B. Terve keemiliste nähtuste klassi lihtsustatud tähistus annab aimu, et lähteainete hulgas on niinimetatud "rünnak" osake, mis asendab reagendis aatomi, iooni või funktsionaalrühma. Asendusreaktsioon on iseloomulik piiravale ja
Asendusreaktsioonid võivad toimuda topeltvahetuse vormis: A-B + C-E A-C + B-E. Üks alamliike on näiteks vase tõrjumine rauaga vasksulfaadi lahusest: CuSO 4 + Fe = FeSO 4 + Cu. "Ründavateks" osakesteks võivad olla aatomid, ioonid või funktsionaalrühmad

Homolüütiline asendus (radikaal, SR)
Kovalentsete sidemete purustamise radikaalse mehhanismi abil jaotatakse molekuli "fragmentide" vahel proportsionaalselt erinevatele elementidele ühine elektronpaar. Moodustuvad vabad radikaalid. Need on ebastabiilsed osakesed, mille stabiliseerumine toimub järgnevate transformatsioonide tulemusena. Näiteks metaanist etaani tootmisel ilmnevad vabad radikaalid, mis osalevad asendusreaktsioonis: CH 4 CH 3. + .N; CH 3. + .CH3 → C2H5; N. + .N → N2. Homolüütilise sideme lõhustamine vastavalt ülaltoodud asendusmehhanismile on ahela iseloomuga. Metaanis saab H-aatomeid järjestikku asendada klooriga. Reaktsioon broomiga toimub sarnaselt, kuid jood ei suuda alkaanides olevat vesinikku otseselt asendama, reageerib nendega liiga jõuliselt.

Heterolüütilise sideme katkestamise meetod
Asendusreaktsioonide ioonilise mehhanismi korral jaotuvad elektronid vastloodud osakeste vahel ebaühtlaselt. Siduv elektronpaar läheb täielikult ühele "fragmendile", kõige sagedamini sidemepartnerile, mille poole polaarses molekulis negatiivne tihedus nihkus. Asendusreaktsioonid hõlmavad metüülalkoholi CH 3 OH moodustumist. Bromometaanis CH3Br on molekuli lõhustamine heterolüütiline ja laetud osakesed on stabiilsed. Metüül omandab positiivse laengu ja broom negatiivse laengu: CH 3 Br → CH 3 + + Br - ; NaOH → Na + + OH-; CH3 + + OH- → CH3OH; Na + + Br - ↔ NaBr.

Elektrofiilid ja nukleofiilid
Osakesi, millel puuduvad elektronid ja mis suudavad neid vastu võtta, nimetatakse "elektrofiilideks". Nende hulka kuuluvad süsinikuaatomid, mis on ühendatud halogeenidega halogeenalkaanides. Nukleofiilidel on suurenenud elektrontihedus, kui nad "annetavad" kovalentse sideme loomisel elektronide paari. Asendusreaktsioonides ründavad negatiivsete laengutega rikkaid nukleofiile elektronnäljas elektrofiilid. Seda nähtust seostatakse aatomi või muu osakese – lahkuva rühma – liikumisega. Teine asendusreaktsiooni tüüp on elektrofiilide rünnak nukleofiili poolt. Mõnikord on raske eristada kahte protsessi ja omistada asendust ühele või teisele tüübile, kuna on raske täpselt määrata, milline molekulidest on substraat ja milline reaktiiv. Tavaliselt võetakse sellistel juhtudel arvesse järgmisi tegureid:
- lahkuva rühma olemus;
- nukleofiilne reaktiivsus;
- lahusti olemus;
- alküülosa struktuur.
Nukleofiilne asendus (SN)
Orgaanilises molekulis toimuva interaktsiooni ajal täheldatakse polarisatsiooni suurenemist. Võrrandites tähistatakse osalist positiivset või negatiivset laengut kreeka tähestiku tähega. Sidemete polarisatsioon võimaldab hinnata selle rebenemise olemust ja molekuli "fragmentide" edasist käitumist. Näiteks jodometaani süsinikuaatomil on osaline positiivne laeng ja see on elektrofiilne tsenter. See tõmbab ligi seda veedipooli osa, kus asub elektronide liiaga hapnik. Kui elektrofiil interakteerub nukleofiilse reagendiga, tekib metanool: CH 3 I + H 2 O → CH 3 OH + HI. Nukleofiilsed asendusreaktsioonid toimuvad negatiivselt laetud iooni või molekuli osalusel vaba elektronpaariga, mis ei osale keemilise sideme loomises. Jodometaani aktiivne osalemine SN 2 reaktsioonides on seletatav selle avatusega nukleofiilsetele rünnakutele ja joodi liikuvusega.

Elektrofiilne asendus (SE)
Orgaaniline molekul võib sisaldada nukleofiilset tsentrit, mida iseloomustab liigne elektrontihedus. See reageerib elektrofiilse reagendiga, millel puuduvad negatiivsed laengud. Sellised osakesed hõlmavad vabade orbitaalidega aatomeid ja madala elektrontihedusega aladega molekule. B-süsinik, millel on "-" laeng, interakteerub veedipooli positiivse osaga - vesinikuga: CH 3 Na + H 2 O → CH 4 + NaOH. Selle elektrofiilse asendusreaktsiooni produkt on metaan. Heterolüütilistes reaktsioonides interakteeruvad vastastikku laetud orgaaniliste molekulide tsentrid, mis muudab need anorgaaniliste ainete keemias sarnaseks ioonidega. Ei maksa unustada, et orgaaniliste ühendite muundumisega kaasneb harva tõeliste katioonide ja anioonide moodustumine.

Monomolekulaarsed ja bimolekulaarsed reaktsioonid
Nukleofiilne asendus on monomolekulaarne (SN1). Seda mehhanismi kasutatakse orgaanilise sünteesi olulise produkti - tertsiaarse butüülkloriidi - hüdrolüüsimiseks. Esimene etapp on aeglane ja on seotud järkjärgulise dissotsiatsiooniga karboniumkatiooniks ja kloriidaniooniks. Teine etapp kulgeb kiiremini, toimub karboniumiooni reaktsioon veega. halogeeni asendamine alkaanis hüdroksürühmaga ja primaarse alkoholi saamine: (CH 3) 3 C-Cl → (CH 3) 3 C + + Cl - ; (CH3)3C+ + H2O → (CH3)3C—OH + H+. Primaarsete ja sekundaarsete alküülhalogeniidide üheastmelist hüdrolüüsi iseloomustab süsinik-halogeensideme samaaegne hävimine ja C-OH paari moodustumine. See on nukleofiilne bimolekulaarne asendus (SN2) mehhanism.
Heterolüütilise asendamise mehhanism
Asendusmehhanism on seotud elektronide ülekande ja vahekomplekside loomisega. Mida kiiremini reaktsioon toimub, seda kergemini tekivad sellele iseloomulikud vaheproduktid. Sageli kulgeb protsess korraga mitmes suunas. Eelis läheb tavaliselt teele, mis kasutab nende moodustamiseks kõige vähem energiat nõudvaid osakesi. Näiteks suurendab kaksiksideme olemasolu allüülkatiooni CH2=CH-CH 2 + ilmnemise tõenäosust võrreldes CH 3 + iooniga. Põhjus peitub mitmiksideme elektrontiheduses, mis mõjutab kogu molekulis hajutatud positiivse laengu delokaliseerumist.
Benseeni asendusreaktsioonid
Rühm, mida iseloomustab elektrofiilne asendus, on areenid. Benseenirõngas on mugav sihtmärk elektrofiilse rünnaku jaoks. Protsess algab sidemete polariseerumisega teises reagendis, mille tulemusena moodustub benseenitsükli elektronpilve kõrval elektrofiil. Selle tulemusena ilmub üleminekukompleks. Elektrofiilse osakese ja ühe süsinikuaatomi vahel pole veel täielikku seost, seda tõmbab kogu "aromaatse kuue" elektroni negatiivne laeng. Protsessi kolmandas etapis on tsükli elektrofiil ja üks süsinikuaatom seotud jagatud elektronide paariga (kovalentne side). Kuid sel juhul hävib “aromaatne kuuik”, mis on stabiilse ja stabiilse energiaseisundi saavutamise seisukohast ebasoodne. Täheldatakse nähtust, mida võib nimetada "prootonite väljutamiseks". H+ elimineeritakse ja areenidele iseloomulik stabiilne sidesüsteem taastub. Kõrvalsaadus sisaldab benseenitsüklist pärit vesinikkatiooni ja teisest reagendist pärit aniooni.

Näited asendusreaktsioonidest orgaanilisest keemiast
Alkaanidele on eriti iseloomulik asendusreaktsioon. Tsükloalkaanide ja areenide kohta võib tuua näiteid elektrofiilsetest ja nukleofiilsetest transformatsioonidest. Sarnased reaktsioonid orgaaniliste ainete molekulides toimuvad tavatingimustes, kuid sagedamini kuumutamisel ja katalüsaatorite juuresolekul. Levinud ja hästi uuritud protsessid hõlmavad aromaatse ringi elektrofiilset asendamist. Seda tüüpi kõige olulisemad reaktsioonid:
- Benseeni nitreerimine H 2 SO 4 juuresolekul toimub vastavalt skeemile: C 6 H 6 → C 6 H 5 -NO 2.
- Benseeni katalüütiline halogeenimine, eelkõige kloorimine, vastavalt võrrandile: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl.
- Aromaatne protsess kulgeb suitseva väävelhappega, tekivad benseensulfoonhapped.
- Alküleerimine on benseenitsükli vesinikuaatomi asendamine alküüliga.
- Atsüülimine - ketoonide moodustumine.
- Formüleerimine on vesiniku asendamine CHO rühmaga ja aldehüüdide moodustumine.
Asendusreaktsioonid hõlmavad reaktsioone alkaanides ja tsükloalkaanides, milles halogeenid ründavad ligipääsetavat CH-sidet. Derivaatide moodustamine võib hõlmata ühe, kahe või kõigi vesinikuaatomite asendamist küllastunud süsivesinikes ja tsükloparafiinides. Paljusid väikese molekulmassiga haloalkaane kasutatakse erinevatesse klassidesse kuuluvate keerukamate ainete tootmiseks. Asendusreaktsioonide mehhanismide uurimisel saavutatud edusammud on andnud võimsa tõuke alkaanidel, tsükloparafiinidel, areenidel ja halogeenitud süsivesinikel põhinevate sünteeside väljatöötamisele.
Valla eelarveline õppeasutus
"Keskkool nr 19"
Michurinsk, Tambovi piirkond
Keemiliste reaktsioonide tüübid
orgaanilises keemias
Golovkina Svetlana Aleksandrovna,
keemiaõpetaja MBOU 19. Keskkool, Mitšurinsk
Sisu
Abstraktne………………………………………………………………………………….3
Sissejuhatus……………………………………………………………………………………4
Testi spetsifikatsioon ……………………………………………… ... 5
Kontrolltööd 9. klass…………………………………………………………………15
Kontrolltööd 11. klass………………………………………………………………………………………24
Teabeallikad…………………………………………………………..33
Annotatsioon.
See töö peegeldab autorite lähenemist orgaanilise keemia keemiliste reaktsioonide tüüpide uurimisele. Kavandatav materjal võib huvi pakkuda alg- ja keskkoolides töötavatele keemiaõpetajatele, kuna see annab orgaanilise keemia keemiliste reaktsioonide tüüpide põhimõistete üldistuse, mis võimaldab neil valmistuda riigieksamiks ja ühtseks riigieksamiks. Eksami- ja praktikamaterjal sellel teemal.
Sissejuhatus.
Orgaanilise keemia materjal on raskesti mõistetav, eriti 9. klassis, kus selle õppimiseks eraldatakse väga vähe aega, suure hulga teoreetilise materjaliga. Orgaanilise keemia küsimused sisalduvad Riigi Teaduste Akadeemia KIM-is ja ühtse riigieksami puhul, kui õpilasi lõputunnistuseks ette valmistades seisab õpetaja sageli silmitsi sellest materjalist arusaamatusega. Saate aktiivselt intensiivistada õppeprotsessi ja parandada orgaanilise keemia assimilatsiooni kvaliteeti, kasutades selle õppimisel kaasaegseid õpetamistehnoloogiaid, näiteks IKT kasutamist, katsekontrolli tehnoloogiaid. Käsiraamatus jagavad õpetajad oma kogemusi väikese, kuid keeruka materjali uurimisel.
Riigieksamiks ja ühtseks riigieksamiks ettevalmistamise testide täpsustus
Testide määramine– hinnata õpilaste üldhariduslikku koolitust keemiliste reaktsioonide liikide kaupa.
Katsematerjali sisu järjepidevus – näidata seost anorgaanilise ja orgaanilise keemia põhimõistete vahel.
Testi sisu omadused – Testi juhtelemendi iga versioon koosneb kolmest osast ja ülesandest. Sama keerukuse ja esitusvormiga ülesanded on koondatud teatud tööosadesse.
A osa sisaldab 10 ülesannet algkeerukusastmega vastuse valimiseks A1, A2 .... A10
B osa sisaldab 3 ülesannet kõrgendatud raskusastmega B1, B2, B3 vastuse valimiseks
Osa C sisaldab 1 ülesannet kõrge keerukuse tase.
Tabel 1 Ülesannete jaotus tööosade kaupa.
Mitme valikuga küsimused Nad kontrollivad põhiosa õpitavast materjalist: keemiateaduse keelt, keemilisi sidemeid, teadmisi orgaaniliste ainete omadustest, keemiliste reaktsioonide liike ja tingimusi.
Kõrgendatud raskusastmega ülesanded Nad kontrollivad teadmisi redoksreaktsioonide kohta kõrgendatud tasemel. Töö pakub valikvastustega ülesandeid.
Kõrgendatud keerukusega ülesannete täitmine võimaldab eristada õpilasi nende ettevalmistustaseme järgi ja anda selle põhjal neile kõrgemaid hindeid.
Pikad vastused küsimustele- testi kõige raskem. Nende ülesannetega testitakse järgmiste sisuelementide assimilatsiooni: aine kogus, aine molaarmaht ja molaarmass, lahustunud aine massiosa.
4.Testiülesannete jaotus sisu, oskuste ja testitavate tegevuste liikide järgi.
Testülesannete sisu määramisel võeti arvesse iga keemiakursusel hõivatud sisuploki mahtu.
5. Juhtimisaeg
Testi sooritamiseks on ette nähtud 45 minutit (1 õppetund)
Individuaalsete ülesannete täitmiseks eraldatud aja ligikaudne jaotus:
iga A-osa ülesande jaoks kuni 2 minutit.
iga B-osa ülesande jaoks kuni 5 minutit.
iga C-osa ülesande jaoks kuni 10 minutit.
6. Üksikute ülesannete ja töö kui terviku hindamissüsteem
Iga A-osa ülesande korrektse täitmise eest hinnatakse 1 punkt.
Iga B-osa ülesande korrektne täitmine hinnatakse 2 punkti;
Ühes vastuseelemendis tehti viga - 1 punkt.
C-osa ülesannete täitmine on muutlik, ülesande C1 korrektne ja täielik täitmine - 4 punkti,
Summeeritakse õpilaste poolt kõigi ülesannete täitmise eest saadud punktid. Hinne antakse viiepallisel skaalal.
7. Hindamise aste:
0% - 25% - punktidest, mis on hinnatud “1”
26% - 50% - saadud "2" punktist
51% - 75% - punktidest, mis said "3"
76% - 85% - punktidest, mis said "4"
86% - 100% - punktidest, mis saadi "5"
Keemiliste reaktsioonide tüübid orgaanilises keemias
Keemiline reaktsioon - see on muutus ainetes, milles vanad keemilised sidemed katkevad ja nende osakeste (aatomite, ioonide) vahele, millest ained ehitatakse, tekivad uued keemilised sidemed.
Keemilised reaktsioonid klassifitseeritakse:
1. Reaktiivide ja toodete arvu ja koostise järgi
Seda tüüpi reaktsioonid võivad hõlmata isomerisatsioonireaktsioone, mis toimuvad muutmata mitte ainult ainete molekulide kvalitatiivset, vaid ka kvantitatiivset koostist.![]()
Erinevalt anorgaanilise keemia lagunemisreaktsioonidest on orgaanilise keemia lagunemisreaktsioonidel oma spetsiifika. Neid võib pidada liitmisele vastupidisteks protsessideks, kuna nende tulemuseks on enamasti mitme sideme või tsükli moodustumine.
CH3-CH2-C=-CH CH3-C=-C-CH3
etüülatsetüleendimetüülatsetüleen



Liitumisreaktsiooni alustamiseks peab orgaanilisel molekulil olema mitmikside (või tsükkel), see molekul on peamine (substraat). Mitmikside katkemise või ringi avanemise kohta lisatakse lihtsam molekul (sageli anorgaaniline aine, reagent). Kõige sagedamini moodustub mitu sidet või tsüklit.![]()



![]()
Nende eristavaks tunnuseks on lihtsa aine ja keerulise aine koostoime. Orgaanilises keemias on "asendamise" mõiste laiem kui anorgaanilises keemias. Kui algse aine molekulis on mõni aatom või funktsionaalrühm asendatud teise aatomi või rühmaga, on need samuti asendusreaktsioonid.

Vahetusreaktsioonid on reaktsioonid, mis toimuvad keerukate ainete vahel, milles nende koostisosad vahetavad kohti. Tavaliselt peetakse neid reaktsioone ioonseks. Ioonide vahelised reaktsioonid elektrolüütide lahustes kulgevad peaaegu täielikult gaaside, sademete ja nõrkade elektrolüütide moodustumisega.![]()

2. Termilise efekti järgi
Eksotermilised reaktsioonid toimuvad energia vabanemisega.
Nende hulka kuuluvad peaaegu kõik ühendi reaktsioonid.
Eksotermilised reaktsioonid, mis tekivad valguse eraldumisel, liigitatakse põlemisreaktsioonideks. Etüleeni hüdrogeenimine on eksotermilise reaktsiooni näide. See töötab toatemperatuuril.
Endotermilised reaktsioonid toimuvad energia neeldumisel.
Ilmselgelt hõlmavad need peaaegu kõiki lagunemisreaktsioone,
CH2 =CH2 + H2 → CH3-CH3

3. Vastavalt katalüsaatori kasutamisele
Need töötavad ilma katalüsaatorita.
Kuna kõik elusorganismide rakkudes toimuvad biokeemilised reaktsioonid toimuvad spetsiaalsete valgulise iseloomuga bioloogiliste katalüsaatorite - ensüümide - osalusel, on need kõik katalüütilised või täpsemalt ensümaatilised.


4. Suuna järgi
Nad voolavad samaaegselt kahes vastassuunas.
Valdav enamus selliseid reaktsioone on.
Orgaanilises keemias peegeldavad pöörduvuse märki protsesside nimetused - antonüümid:
hüdrogeenimine - dehüdrogeenimine,
hüdratsioon - dehüdratsioon,
polümerisatsioon - depolümerisatsioon.
Kõik reaktsioonid on pöörduvad esterdamine (vastast protsessi, nagu teate, nimetatakse hüdrolüüsiks) ja valkude, estrite, süsivesikute, polünukleotiidide hüdrolüüsi. Nende protsesside pöörduvus on elusorganismi kõige olulisema omaduse – ainevahetuse – aluseks.
Nendel tingimustel voolavad nad ainult ühes suunas.
Nende hulka kuuluvad kõik vahetusreaktsioonid, millega kaasneb sademe, gaasi või kergelt dissotsieeruva aine (vee) moodustumine ja kõik põlemisreaktsioonid.
5. Vastavalt liiteseisundile
Reaktsioonid, milles reagendid ja reaktsioonisaadused on erinevates agregatsiooniseisundites (erinevates faasides).
Reaktsioonid, milles reagendid ja reaktsiooniproduktid on samas agregatsiooniseisundis (samas faasis).


6. Muutes aineid moodustavate keemiliste elementide oksüdatsiooniastmeid
Reaktsioonid, mis toimuvad keemiliste elementide oksüdatsiooniastmeid muutmata. Nende hulka kuuluvad näiteks kõik ioonivahetusreaktsioonid, aga ka paljud liitumisreaktsioonid, paljud lagunemisreaktsioonid, esterdamisreaktsioonid
Reaktsioonid, mis tekivad elementide oksüdatsiooniastmete muutumisel. Nende hulka kuuluvad paljud reaktsioonid, sealhulgas kõik asendusreaktsioonid, aga ka kombinatsiooni- ja lagunemisreaktsioonid, milles osaleb vähemalt üks lihtne aine.
HCOOH + CH 3 OH → HCOOCH3 + H2O

7. Vastavalt voolumehhanismile.
Nad lähevad reaktsiooni käigus tekkinud radikaalide ja molekulide vahele.
Nagu te juba teate, katkevad kõigis reaktsioonides vanad keemilised sidemed ja tekivad uued keemilised sidemed. Lähteaine molekulides oleva sideme katkestamise meetod määrab reaktsiooni mehhanismi (tee). Kui aine moodustub kovalentse sidemega, võib selle sideme katkestamiseks olla kaks võimalust: hemolüütiline ja heterolüütiline. Näiteks molekulide Cl2, CH4 jne puhul toimub sidemete hemolüütiline lõhustamine, mis põhjustab paaritute elektronidega osakeste, st vabade radikaalide moodustumist.
Need lähevad ioonide vahele, mis on juba olemas või reaktsiooni käigus tekkinud.
Tüüpilised ioonreaktsioonid on interaktsioonid lahuses olevate elektrolüütide vahel. Ioonid moodustuvad mitte ainult elektrolüütide dissotsiatsioonil lahustes, vaid ka elektrilahenduste, kuumutamise või kiirguse toimel. Ŷ-kiired muudavad näiteks vee ja metaani molekulid molekulaarseteks ioonideks.
Teise ioonmehhanismi kohaselt toimuvad vesinikhalogeniidide, vesiniku, halogeenide alkeenidele lisamise reaktsioonid, alkoholide oksüdatsioon ja dehüdratsioon, alkoholi hüdroksüüli asendamine halogeeniga; aldehüüdide ja hapete omadusi iseloomustavad reaktsioonid. Sel juhul moodustuvad ioonid polaarsete kovalentsete sidemete heterolüütilise lõhustamise teel.

8. Reaktsiooni käivitava energia liigi järgi.




Neid käivitab suure energiaga kiirgus – röntgenikiirgus, tuumakiirgus (Ý-kiired, a-osakesed – He2+ jne). Kiirgusreaktsioonide abil viiakse läbi väga kiire radiopolümerisatsioon, radiolüüs (kiirguse lagunemine) jne.
Näiteks benseenist kaheetapilise fenooli tootmise asemel saab seda saada benseeni reageerimisel veega kiirguse mõjul. Sel juhul tekivad veemolekulidest radikaalid [·OH] ja [·H·], millega benseen reageerib, moodustades fenooli:
C6H6 + 2[OH] -> C6H5OH + H20
Kummi vulkaniseerimist saab läbi viia ilma väävlita, kasutades radiovulkaniseerimist ja saadud kumm ei ole halvem kui traditsiooniline
Neid käivitab soojusenergia. Nende hulka kuuluvad kõik endotermilised reaktsioonid ja paljud eksotermilised reaktsioonid, mille käivitamiseks on vaja esialgset soojusvarustust, st protsessi käivitamist.
Neid käivitab valgusenergia. Lisaks ülalpool käsitletud HCl sünteesi fotokeemilistele protsessidele või metaani reaktsioonile klooriga hõlmavad need osooni kui sekundaarse atmosfääri saasteaine tootmist troposfääris.
Seda tüüpi reaktsioonide hulka kuulub ka taimerakkudes toimuv kõige olulisem protsess, fotosüntees.Neid käivitab elektrivool. Lisaks tuntud elektrolüüsireaktsioonidele toome välja ka elektrosünteesireaktsioonid, näiteks reaktsioonid anorgaaniliste oksüdeerivate ainete tööstuslikuks tootmiseks.
Kontrollülesanded 9. klassile
1. võimalus.
A osa
A1. Millised mudelid vastavad alkeeni molekulidele?

a) kõik peale A
b) kõik peale B
c) kõik peale B
d) kõik peale G
A2. Millise reagendiga võivad alkaanid reageerida:
a) Br2 (lahus)
b) Cl 2 (hele)
c) H2SO4
d) NaOH
A3. 1,3-butadieeni reaktsioonis HCl-ga ei saa tekkida
a) 3-klorobuteen-1 c) 1-klorobuteen-2
b) 4-klorobuteen-1 d) 2,3-diklorobutaan
A4. Aine, millega sipelghape sobivatel tingimustel redoksreaktsiooni siseneb, on:
a) vask;
b) vask(II)hüdroksiid;
c) vask(II)kloriid;
d) vask(II)sulfaat.
A5. Estri koostoimet veega võib nimetada:
a) hüdratsioon;
b) dehüdratsioon;
c) hüdrolüüs;
d) hüdrogeenimine.
A6. Muutuste ahelas
reaktsioonid "a" ja "b" on vastavalt:
a) hüdratatsioon ja oksüdatsioon;
b) oksüdatsioon ja hüdratsioon;
c) hüdratatsioon ja hüdratatsioon;
d) oksüdatsioon ja oksüdatsioon.
A7. Reaktsioon, mille põhjustab kaksiksideme olemasolu karbonüülühendite molekulides, on reaktsioon:
a) ühinemine;
b) lagunemine;
c) asendamine;
d) vahetus.
A8. Hõbeoksiidi ammoniaagilahuse abil on võimatu ära tunda:
a) etanool ja etanaal;
b) propanaal ja propanoon;
c) propanaal ja glütseriin;
d) butanaal ja 2-metüülpropanaal.
A9. Kui propenaal puutub kokku liigse vesinikuga, moodustub see Mina:
a) alkoholi piiramine;
b) küllastumata alkohol;
c) küllastumata süsivesinik;
d) küllastunud süsivesinik.
A10. Atsetaldehüüd tekib hüdratatsiooni käigus:
a) etaan;
b) eteen;
c) etina;
d) etanool.
B osa
B1. Ühendage reaktsiooni tüüp võrrandiga
REAKTSIOONI TÜÜP
B2. Atsetüleen massiga 10,4 g lisati vesinikkloriidi massiga 14,6 g Reaktsioonisaaduse valem on _____.
B3. Tehnilisest kaltsiumkarbiidist kaaluga 1 kg saadi atsetüleen mahuga 260 l (n.s.). Kaltsiumkarbiidi proovis sisalduvate lisandite massiosa (%) on ____ _____. (Kirjuta oma vastus sajandiku täpsusega).
C osa.
C 1. Kirjutage reaktsioonivõrrandid, mille abil saate teha järgmist
BaCl2
teisendused: CO
2. võimalus.
A osa Iga ülesande A1-A10 jaoks on antud neli vastusevarianti,
millest ainult üks on õige. Tõmba vastuse number ümber.
A1. Alkaanidele iseloomulik reaktsioon
a) ühinemine
b) asendamine
c) hüdratsioon
d) vahetus
A2. Milliseid süsivesinikke iseloomustavad polümerisatsioonireaktsioonid?
a) CH
4b) C 2 H 4
c) C 6 H 6
d) C 2 H 5OH
A3. Aine, millega metaan läbib nihkumisreaktsiooni.
a) CL 2 (hele)
b) H 2 O
c) H 2 SO 4
d) NaOH
A4. Milline aine oksüdeerub kergesti kaaliumpermanganaadiga.
a) C 2 H 6
b) C 2 H 2
c) C 2 H 5OH
d) C 6 H 6
A5. Millisel ainel võib tekkida dehüdratsioonireaktsioon.
a) C 2 H 4
b) C 2 H 5OH
c) CH 4
d) CH 3 COH
A6. Muutuste ahelas C 2 H 6 – atsetüleen – etaan reaktsioonid “a” ja “b” – see vastab
a) hüdratsioon ja hüdrogeenimine
b) hüdratatsioon ja oksüdatsioon
c) dehüdrogeenimine ja hüdrogeenimine
d) oksüdatsioon ja hüdratsioon
A7. Kuidas nimetatakse reaktsiooni, mille käigus tekivad estrid?
a) ühinemine
b) asendamine
c) esterdamine
d) lagunemine
A8. Kui etüleen reageerib veega, moodustub see.
a) alkoholi piiramine
b) küllastumata alkohol
c) küllastunud süsivesinik
d) küllastumata süsivesinik
A9. Äädikhape moodustub:
a) etaan
b) eteen
c) etina
d) etanool
A10. Milline reaktsioon on tüüpiline rasvadele?
a) ühinemine
b) oksüdatsioon
c) hüdrolüüs
d) asendamine
B osaÜlesannete B1 täitmisel loo kirjavahetus. Q2 ja Q3, tehke arvutused ja kirjutage vastus üles.
B1. Sobitage reaktsiooni tüüp ainega
Reaktsiooni tüüp
B2. Täielikuks põlemiseks vajalik hapniku maht on 50 liitrit. metaan (n.s.) on võrdne ___l.
B3. Süsivesinik sisaldab 16,28% vesinikku. Määrake süsivesiniku valem, kui selle vesiniku aurutihedus on 43.
C osa. Ülesande C1 vastuste jaoks kasutage eraldi vormi (lehte)
Kirjuta üles ülesande number ja vastus sellele.
C1. Arvutage süsinikdioksiidi maht, mis eraldub 56 liitri metaani põletamisel 48 liitriks hapnikuks
VASTUSED
1. võimalus
A osa
B osa
C osa
Kirjutage reaktsioonivõrrandid, mille abil saate teha järgmist BaCl 2
teisendused: CO 2 → Na 2 CO 3 → X → CO 2. Teise protsessi jaoks kirjutage reaktsiooni ioonvõrrand.
Vastus
2. võimalus
A osa
A1
B osa
C osa
Kontrollülesanded 11. klassile
1. võimalus.
A osa Iga ülesande A1-A10 jaoks on antud neli vastusevarianti,
millest ainult üks on õige. Tõmba vastuse number ümber.
A1. Wurtzi reaktsioon vastab kirjeldusele:
1. atsetüleenhüdratsioon
2. süsinikskeleti pikenemine
3. nitroderivaatide redutseerimine metallidega happelises keskkonnas
4. etanooli samaaegne dehüdratsioon ja dehüdrogeenimine
A2. Glükoosi ja sahharoosi saab eristada:
1. lämmastikhape
2. hõbeoksiidi ammoniaagilahus
3. vesi
4. naatriumhüdroksiid.
A3. Etanooli saab reaktsiooni käigus toota etüleenist
1. niisutamine
2. hüdrogeenimine
3.Halogeenimine
4. Hüdrohalogeenimine
A4. Reaktsioon hõbeoksiidi ammoniaagilahusega on iseloomulik
1. propanool-1
2. propanaal
3. propanool-2
4. dimetüüleeter
A5. Etüülformiaadi aluseline hüdrolüüs tekitab
1. formaldehüüd ja etanool
2. sipelghape ja etanool
3. sipelghappe sool ja etanool
4. formaldehüüd ja sipelghape
A6. Kucherovi reaktsiooni eripäraks on ainete koostoime
1. vesinikuga
2. klooriga
3. veega
4. happega
A7. Aromaatsetele süsivesinikele iseloomulikul tsiniini reaktsioonil on erinev nimi
1. kloorimine
2. broomimine
3. nitreerimine
4. hüdrogeenimine
A8. Kvalitatiivne reaktsioon mitmehüdroksüülsetele alkoholidele on nende koostoime
1. vaskoksiidiga ( II)
2. vaskhüdroksiidiga ( II)
3. vasega
4. vaskoksiidiga ( I)
A9. Etanooli reageerimisel vesinikkloriidhappega väävelhappe juuresolekul,
1. etüleen
2. kloroetaan
3. 1,2-dikloroetaan
4. vinüülkloriid
A10. Erinevalt etanaalist reageerib äädikhape
1. magneesium
2. vaskhüdroksiid ( II)
3. hapnik
4. vesinik
B osa
kirjutage need kasvavas järjekorras
B1. Kompositsiooniga C5H10O2 estrite hüdrolüüsi saadused võivad olla
1. pentanal ja metanool
2. propaanhape ja etanool
3. etanool ja butanaal
4. butaanhape ja metanool
5. etaanhape ja propanool
6. formaldehüüd ja pentanool
B2. Reageerib sipelghappega
1. Na 2 CO 3
2. HCl
3.OH
4. H 2 S
5. CuSO 4
6. Cu(OH)2
B3. Ained, millega α-aminopropaanhape võib interakteeruda
1. etaan
2. kaaliumhüdroksiid
3. kaaliumkloriid
4. väävelhape
5. dimetüüleeter
6. vesinikkloriid
C osa. Ülesande C1 vastuste jaoks kasutage eraldi vormi (lehte)
Kirjuta üles ülesande number ja vastus sellele.
C1. Propaani katalüütilise oksüdeerimise tulemusena saadi propioonhape massiga 55,5 g. Reaktsioonisaaduse massiosa on 60%. Arvutage võetud propaani maht (nr).
2. võimalus
A osa Iga ülesande A1-A10 jaoks on antud neli vastusevarianti,
millest ainult üks on õige. Tõmba vastuse number ümber.
A1. Kumbki kahest ainest reageerib normaalsetes tingimustes broomveega:
1. benseen ja tolueen
2. tsükloheksaan ja propeen
3. etüleen ja benseen
4. fenool ja atsetüleen
A2. Etüleen moodustub reaktsiooni tulemusena:
1. atsetüleeni hüdratsioon
2. klorometaan naatriumiga
3. atsetüleen vesinikkloriidiga
4. etanooli dehüdratsioon
A3. Etanooli saab reaktsiooni teel toota etüleenist
1. hüdratsioon
2. hüdrogeenimine
3. halogeenimine
4. hüdrohalogeenimine
A4. Atsetüleeni trimerisatsioonireaktsiooni tulemusena moodustub:
1. heksaan
2. hekseen
3. etaan
4. benseen
A5. Etüleeni oksüdeerimisel CM vesilahusega nO 4 moodustub:
1. etaan
2. etanool
3. glütserool
4. etüleenglükool
A6. 2-klorobutaani aluseline hüdrolüüs annab peamiselt:
1. butanool-2
2. butanool-1
3. butanaal
4. butanoon
A7. Asendusreaktsioon klooriga hõlmab:
1. eteen 2. etiin 3 . buteen-2 4. butaan
A8. Mitmehüdroksüülsete alkoholide iseloomulik reaktsioon on koostoime:
1. H 2
2. Cu
3. Ag 2 O (NH 3 lahus)
4. Cu(OH)2
A9. Monomeer kunstkummi tootmiseks Lebedevi meetodil on:
1. buteen-2
2. etaan
3. etüleen
4. butadieen-1,3
A10. Butanool-2 ja kaaliumkloriid tekivad koostoimel:
1. 1-klorobutaan ja 2-klorobutaan
2. 2-klorobutaan ja KOH alkoholilahus
3. 1-klorobutaan ja KOH alkoholilahus
4. 2-klorobutaan ja KOH vesilahus
B osa Ülesannete B1-B3 täitmisel valige kolm vastusevarianti ja
kirjutage need kasvavas järjekorras
B1. Kompositsiooniga C6H12O2 estrite hüdrolüüsi saadused võivad olla
1 . etanaal ja dimetüüleeter
2 . propaanhape ja propanool
3 . metüülatsetaat ja butaan
4 . etaanhape ja butanool
5. pentaanhape ja metanool
6. propanaal ja etaandiool
B2. Alkeenid suhtlevad:
1 . [ Ag(NH3)2]OH
2 . H2O
3 . BR 2
4 . KMnO4(H+)
5 . Ca(OH)2
6 . Cu(OH)2
B3. Metüületüülamiin interakteerub:
1 . etaan
2 . kaaliumhüdroksiid
3. vesinikbromiidhape
4 . hapnikku
5 . propaan
6 . vesi
C osa. Ülesande C1 vastuste jaoks kasutage eraldi vormi (lehte)
Kirjuta üles ülesande number ja vastus sellele.
C1. Ammoniaagigaas vabaneb, kui 160 g 7% kaaliumhüdroksiidi lahust keedetakse 9,0 g-ga. Ammooniumkloriid, lahustatud 75 g vees. Määrake saadud lahuses ammoniaagi massiosa.
VASTUSED
1. võimalus
A osa
A1
B osa
B1
C osa
Õige vastuse sisu ja hindamisjuhend (lubatud on ka muu vastuse sõnastus, mis ei moonuta selle tähendust)
Vastuse elemendid:
1. Reaktsioonivõrrand on koostatud
3C 2 H2  C6H6
C6H6
2. Määrati atsetüleeni ja benseeni kogused
n(C2H2) = 10,08/22,4 = 0,45 mol
vastavalt reaktsioonivõrrandile n(C2H2): n(C6H6) = 3:1
n(C6H6) = 0,45/3 = 0,15 mol
3. Arvutatakse benseeni teoreetiline mass
m(C6H6) = 0,15 mol * 78 g/mol = 11,7 g
4. Arvutatakse benseeni praktiline mass
m(C6H6) pr = 0,7 * 11,7 = 8,19 g
2. võimalus
A osa
B osa
C osa
C 1 1. 160 g 7% kaaliumhüdroksiidi lahuse keetmisel eraldub gaas 9,0 g ainega. Ammooniumkloriid, lahustatud 75 g vees. Määrake saadud lahuses ammoniaagi massiosa.
Õige vastuse sisu ja hindamisjuhend Vastuse elemendid:- Koostatakse reaktsioonivõrrand:
- Leelise mass ja kogus lahuses, samuti ammooniumkloriidi aine kogus arvutatakse:
- Aine, mida lahuses on liias, on näidatud:
- Määrati ammoniaagi mass ja selle massiosa lahuses
*Märkus. Kui vastuses on mõnes vastuseelemendis arvutusviga, mis tõi kaasa vale vastuse, vähendatakse ülesande täitmise punktisummat vaid 1 punkti võrra.
Teabeallikad.
Artemenko A.I. Orgaanilise keemia imeline maailm. – M.: Bustard, 2004.
Gabrielyan O.S., Ostroumov I.G. Õpetaja käsiraamat. Keemia. 10. klass. – M.: Bustard, 2004.
Koroštšenko A.S., Medvedev Yu.N. Keemia GIA standardtesti ülesanded - M.: “Eksam”, 2009.
Kuznetsova N.E., Levkina A.N., Ülesannete raamat keemias, 9. klass. – M.: Kirjastuskeskus “Ventana – Graf”, 2004.
Kuznetsova N.E., Titova I.M., Gara N.N., Zhegin A.Yu. Keemia. – 9. klass. – M.: Kirjastuskeskus “Ventana – Graf”, 2002.
Potapov V.M. Orgaaniline keemia. – M.: Haridus, 1976.
Noore keemiku entsüklopeediline sõnastik. – M.: Pedagoogika – Press, 1997.
Pichugina G.V. Keemia ja inimese igapäevaelu. – M.: Bustard, 2005.
http://www.fipi.ru/
Orgaaniliste reaktsioonide jaoks on olemas erinevad klassifikatsioonisüsteemid, mis põhinevad erinevatel omadustel. Nende hulgas on järgmised klassifikatsioonid:
- poolt reaktsiooni lõpptulemus, see tähendab substraadi struktuuri muutust;
- poolt reaktsiooni mehhanismst sideme katkemise tüübi ja reaktiivide tüübi järgi.
Orgaanilises reaktsioonis interakteeruvad ained jagunevad reaktiiv Ja substraat. Sel juhul arvatakse, et reaktiiv ründab substraati.
MÄÄRATLUS
Reaktiiv- aine, mis toimib objektil - substraadil - ja põhjustab selles keemilise sideme muutuse. Reagendid jagunevad radikaalseteks, elektrofiilseteks ja nukleofiilseteks.
MÄÄRATLUS
Substraatüldiselt peetakse molekuliks, mis annab uue sideme jaoks süsinikuaatomi.
REAKTSIOONIDE KLASSIFIKATSIOON LÕPPTULEMUSE JÄRGI (ALMINE STRUKTUURI MUUTUS)
Orgaanilises keemias eristatakse vastavalt lõpptulemusele ja substraadi struktuuri muutusele nelja tüüpi reaktsioone: liitmine, asendamine, irdumine, või kõrvaldamine(inglise keelest kõrvaldada- eemaldada, tükeldada) ja ümberkorraldused (isomerisatsioonid)). See klassifikatsioon sarnaneb reaktsioonide klassifikatsiooniga anorgaanilises keemias esialgsete reaktiivide ja saadud ainete arvu järgi koos koostise muutumisega või ilma. Lõpptulemuse järgi klassifitseerimine põhineb formaalsetel kriteeriumidel, kuna stöhhiomeetriline võrrand reeglina reaktsioonimehhanismi ei kajasta. Võrdleme anorgaanilise ja orgaanilise keemia reaktsioonide liike.
Reaktsiooni tüüp anorgaanilises keemias | Näide | Reaktsiooni tüüp orgaanilises keemias | Mitmekesisus ja eeskuju Reaktsioonid |
|---|---|---|---|
1. Ühendus | C l2 + H2 = 2 H Cl | Liitumine mitme ühenduse kaudu | Hüdrogeenimine |
Hüdrohalogeenimine
|
|||
Halogeenimine
|
|||
Niisutus
|
|||
2. Lagunemine | 2
H2
O=2 H2
+
O2
| Elimineerimine | Dehüdrogeenimine
|
Dehüdrohalogeenimine
|
|||
Dehalogeenimine
|
|||
Dehüdratsioon
|
|||
3. Asendamine | Zn + 2 H Cl =ZnCl2+H2 | Asendamine |
|
4. Vahetus (erijuhtum – neutraliseerimine) | H2 S O4 + 2 N a O H=Na2S04 + 2H 2 O | erijuhtum - esterdamine |
|
5. Allotropiseerimine | grafiit ⇔ teemant Ppunane⇔ Pvalge P punane ⇔ P valge Sromb.⇔ Splast. Srhomb.⇔Splast. | Isomerisatsioon | Isomerisatsioon alkaanid
|
n) ilma neid teistega asendamata.
Sõltuvalt sellest, millised aatomid on eraldatud - naaberaatomid C–C või isoleeritud kahe või kolme või enama süsinikuaatomiga – C–C–C– C–, –C–C–C–C– C–, võivad tekkida ühendid koos mitu võlakirja ja või tsüklilised ühendid. Vesinikhalogeniidide eemaldamine alküülhalogeniididest või veest alkoholidest toimub Zaitsevi reegli kohaselt.
MÄÄRATLUS
Zaitsevi reegel: vesinikuaatom H eemaldatakse kõige vähem hüdrogeenitud süsinikuaatomist.
Näiteks vesinikbromiidi molekuli elimineerimine toimub naaberaatomitest leelise juuresolekul, mille tulemusena moodustuvad naatriumbromiid ja vesi.
MÄÄRATLUS
Ümberrühmitamine- keemiline reaktsioon, mille tulemusena muutub molekulis aatomite suhteline paigutus, mitme sideme liikumine või nende paljususe muutumine.
Ümberkorraldamine võib toimuda, säilitades molekuli aatomkoostise (isomerisatsioon) või muutes seda.
MÄÄRATLUS
Isomerisatsioon- ümberkorraldusreaktsiooni erijuhtum, mis põhjustab keemilise ühendi muutumist isomeeriks süsiniku skeleti struktuurimuutuse kaudu.
Ümberkorraldamine võib toimuda ka homolüütilise või heterolüütilise mehhanismi kaudu. Molekulaarseid ümberkorraldusi saab klassifitseerida erinevate kriteeriumide järgi, näiteks süsteemide küllastumise, migreeruva rühma olemuse, stereospetsiifilisuse jne järgi.. Paljudel ümberkorraldusreaktsioonidel on spetsiifilised nimetused - Claiseni ümberkorraldus, Beckmanni ümberkorraldus jne.
Isomerisatsioonireaktsioone kasutatakse laialdaselt tööstusprotsessides, näiteks nafta rafineerimisel, et suurendada bensiini oktaanarvu. Isomerisatsiooni näide on transformatsioon n-oktaani isooktaani:
ORGAANILISTE REAKTSIOONIDE KLASSIFIKATSIOON REAGENDI TÜÜBI JÄRGI
ÜHENDAMINE
Sidemete lõhustumine orgaanilistes ühendites võib olla homolüütiline või heterolüütiline. 
MÄÄRATLUS
Homolüütilise sideme lõhustumine- see on katkestus, mille tulemusena saab iga aatom paaritu elektroni ja moodustub kaks osakest, millel on sarnane elektrooniline struktuur - vaba radikaalid.
Homolüütiline katkestus on iseloomulik mittepolaarsele või nõrgalt polaarsele sidemeid, nagu C–C, Cl–Cl, C–H, ja nõuab palju energiat.
Tekkivad radikaalid, millel on paaritu elektron, on väga reaktiivsed, seetõttu on selliste osakeste osalusel toimuvad keemilised protsessid sageli "ahela" iseloomuga, neid on raske kontrollida ja reaktsiooni tulemuseks on asendusproduktide kogum. . Seega, kui metaani klooritakse, on asendusproduktideks klorometaan C H3 C l CH3Cl
, diklorometaan C H2 C l2 CH2Cl2, kloroform C H C l3 CHCl3 ja süsiniktetrakloriid C C l4 CCl4. Vabade radikaalidega seotud reaktsioonid kulgevad keemiliste sidemete moodustumise vahetusmehhanismi kaudu.Sellise sideme lõhustumise käigus tekkinud radikaalid põhjustavad radikaalne mehhanism reaktsiooni käik. Radikaalsed reaktsioonid tekivad tavaliselt kõrgemal temperatuuril või kiirgusel (nt valgusel).
Oma kõrge reaktsioonivõime tõttu võivad vabad radikaalid avaldada negatiivset mõju inimkehale, hävitades rakumembraane, mõjutades DNA-d ja põhjustades enneaegset vananemist. Need protsessid on seotud peamiselt lipiidide peroksüdatsiooniga, see tähendab polüküllastumata hapete struktuuri hävitamisega, mis moodustavad rakumembraanis rasva.
MÄÄRATLUS
Heterolüütilise sideme lõhustumine- see on tühimik, millesse jääb elektronpaar elektronegatiivsema aatomiga ja moodustub kaks laetud osakest - ioonid: katioon (positiivne) ja anioon (negatiivne).
Keemilistes reaktsioonides täidavad need osakesed " nukleofiilid"("phil" - gr. armastus) ja " elektrofiilid", moodustades doonor-aktseptormehhanismi kohaselt reaktsioonipartneriga keemilise sideme. Nukleofiilsed osakesed moodustavad uue sideme moodustamiseks elektronpaari. Teisisõnu
MÄÄRATLUS
Nukleofiil- elektronirikas keemiline reagent, mis on võimeline interakteeruma elektronidefitsiitsete ühenditega.
Nukleofiilide näideteks on mis tahes anioonid ( C l− , I− , N O− 3 Cl−,I−,NO3− jne), samuti ühendid, millel on üksik elektronpaar ( N H3 , H2 O NH3, H2O
).Seega võivad sideme katkemisel tekkida radikaalid ehk nukleofiilid ja elektrofiilid. Sellest lähtuvalt ilmnevad kolm orgaaniliste reaktsioonide mehhanismi.
ORGAANILISTE REAKTSIOONIDE MEHHANISMID
Vabade radikaalide mehhanism: reaktsiooni käivitavad vabad radikaalid, mis moodustuvad siis, kui homolüütiline rebend sidemed molekulis.
Kõige tüüpilisem variant on kloori- või broomiradikaalide teke UV-kiirguse ajal.
1. Vabade radikaalide asendus

metaan bromometaan
Ahelalgatus

Ahela kasv
Avatud vooluring
2. Vabade radikaalide lisamine
eteen polüetüleen
Elektrofiilne mehhanism: reaktsiooni käivitavad elektrofiilsed osakesed, mis saavad selle tulemusena positiivse laengu heterolüütiline rebend side. Kõik elektrofiilid on Lewise happed.
Sellised osakesed moodustuvad aktiivselt Lewise happed, mis suurendavad osakese positiivset laengut. Kõige sagedamini kasutatav A l C l3 , F e C l3 , F e B r3 ,ZnC l2 AlCl3, FeCl3, FeBr3, ZnCl2, mis täidab katalüsaatori funktsioone.
Elektrofiilse osakese ründekohaks on need molekuli osad, millel on suurenenud elektrontihedus, st mitmikside ja benseenitsükkel.
Elektrofiilsete asendusreaktsioonide üldist vormi saab väljendada võrrandiga:
1. Elektrofiilne asendus

benseen bromobenseen
2. Elektrofiilne ühendus
propeen 2-bromopropaan
propüün 1,2-dikloropropeen
Ebasümmeetriliste küllastumata süsivesinike lisamine toimub vastavalt Markovnikovi reeglile.
MÄÄRATLUS
Markovnikovi reegel: tingliku valemiga HX (kus X on halogeeniaatom või hüdroksüülrühm OH–) komplekssete ainete molekulide ebasümmeetrilistele alkeenidele lisandub vesinikuaatom kaksiksideme juures kõige hüdrogeenitud (enim vesinikuaatomeid sisaldava) süsinikuaatomile ja X kuni kõige vähem hüdrogeenitud.
Näiteks vesinikkloriidi HCl lisamine propeeni molekulile C H3 – CH = C H2 CH3-CH=CH2.

Reaktsioon kulgeb elektrofiilse lisamise mehhanismi abil. Elektrone loovutava mõju tõttu C H3 CH3-rühmas nihkub elektrontihedus substraadi molekulis tsentraalsele süsinikuaatomile (induktiivne efekt) ja seejärel mööda kaksiksidemete süsteemi - terminaalsele süsinikuaatomile. C H2 CH2-rühmad (mesomeerne efekt). Seega paikneb liigne negatiivne laeng täpselt sellel aatomil. Seetõttu algab rünnak vesiniku prootoniga H+ H+, mis on elektrofiilne osake. Moodustub positiivselt laetud karbeeniioon [C H3 – CH – C H3 ] + + , millele lisatakse kloorianioon C l− Cl−.
MÄÄRATLUS
Erandid Markovnikovi reeglist: Liitmisreaktsioon kulgeb vastuollu Markovnikovi reegliga, kui reaktsioon hõlmab ühendeid, milles kaksiksideme süsinikuaatomiga külgnev süsinikuaatom neelab osaliselt elektrontiheduse, st asendajate juuresolekul, millel on märkimisväärne elektrone äratõmbav toime. (–C C l3 , – C N , – C O O H(–CCl3,–CN,–COOH jne).

Nukleofiilne mehhanism: reaktsioon algab negatiivse laenguga nukleofiilsete osakestega, mis tekivad selle tulemusena heterolüütiline rebend side. Kõik nukleofiilid - Lewise sihtasutused.
Nukleofiilsete reaktsioonide korral on reagendil (nukleofiilil) ühel aatomil vaba elektronide paar ja see on neutraalne molekul või anioon ( H a l– , O H– , R O− , R S– , R C O O– , R– , C N – , H2 O, R O H, N H3 , RN H2 Hal–,OH–,RO–,RS–,RCOO–,R–,CN–,H2O,ROH,NH3,RNH2 jne).
Nukleofiil ründab substraadis olevat aatomit madalaima elektrontihedusega (st osalise või täieliku positiivse laenguga). Nukleofiilse asendusreaktsiooni esimene etapp on substraadi ioniseerimine karbokatiooni moodustamiseks. Sel juhul moodustub nukleofiili elektronpaari tõttu uus side ja vana läbib heterolüütilise lõhustamise koos järgneva katiooni elimineerimisega. Nukleofiilse reaktsiooni näide on nukleofiilne asendus (sümbol SN SN) küllastunud süsinikuaatomi juures, näiteks bromoderivaatide aluseline hüdrolüüs.
1. Nukleofiilne asendus
2. Nukleofiilne lisamine

etanaal tsüanohüdriin
allikas http://foxford.ru/wiki/himiya